
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
КЭС 1.1.1. Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов.
Стр 1 из 2Следующая ⇒
КЭС 1.1.1. Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов.
Умения и виды деятельности, проверяемые заданиями КИМ
1.2.1. Применять основные положения химических теорий (строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических соединений, химической кинетики) для анализа строения и
свойств веществ.
2.3.1. s-, p- и d-элементы по их положению в Периодической системе Д.И. Менделеева.
Уровень базовый. Максимальный балл 1.
Время выполнения 1-2 мин.
| СТРОЕНИЕ АТОМА | Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
ВИДЕОРОЛИКИ МОДЕЛИ АТОМОВ
https://www.youtube.com/watch?v=OCInhp3wHdI
https://www.youtube.com/watch?v=1LILlHxLDZs
https://www.youtube.com/watch?v=U6Oq4EBghIM
https://www.youtube.com/watch?v=9t2EIQhPc54
https://www.youtube.com/watch?v=0Tsn9QfS6qA
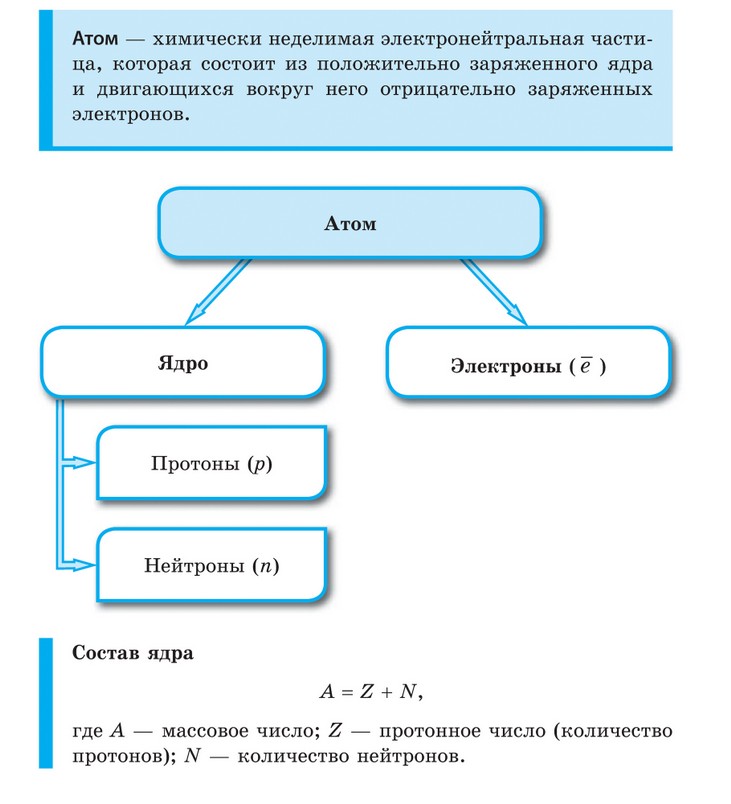 Атом любого химического элемента сравним с Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов - протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus - ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Атом любого химического элемента сравним с Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов - протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus - ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
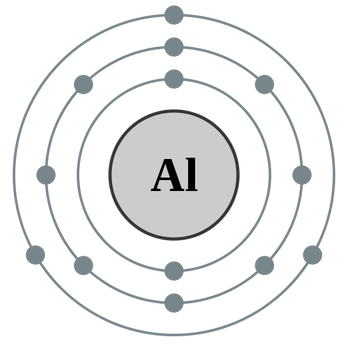 13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
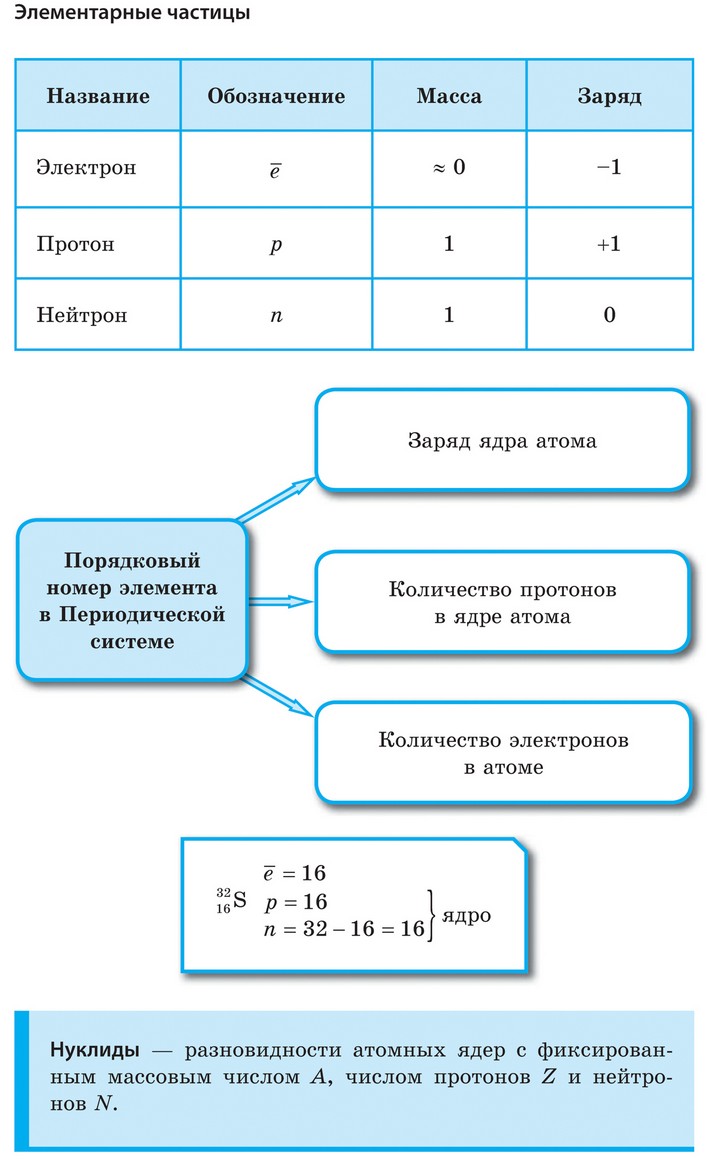
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e—.
Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e—.
Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
 N = A-Z
Например, число нейтронов в атоме железа равно:
56 - 26 = 30
N = A-Z
Например, число нейтронов в атоме железа равно:
56 - 26 = 30
 Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. д. Приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы.
Изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. д. Приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы.
Изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
 https://www.youtube.com/watch?v=fMZLMqEMpBE
https://www.youtube.com/watch?v=fMZLMqEMpBE


|
| СОВРЕМЕННОЕ ПРЕДСТАВЛЕНИЕ О СТРОЕНИИ АТОМА | Модель Резерфорда несовершенна. Согласно законам классической физики атом из положительно заряженного ядра и электронов, обращающимся по круговым орбитам, должен излучать электромагнитные волны. Излучение электромагнитных волн должно приводить к уменьшению запаса энергии, к постепенному уменьшению радиуса орбиты электрона и падению электрона на ядро. Однако атомы обычно не излучают электромагнитные волны, электроны не падают на атомные ядра, то есть атомы устойчивы. Попытки построить модель атома в рамках классической физики не привели к успеху.
Строение атома по Бору
Бор предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний): «в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
Второй постулат Бора: «при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией, равной разности энергий соответствующих стационарных состояний. Происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую) или его поглощение (переход атома в состояние с большей энергией, т.е. переход атома на более отдалённую от ядра орбиту).
 Квантовая теория строения атома
Подтверждённая экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны – корпускулярно-волновой дуализм, побудила учёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой - его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства. (см. состояние электрона в атоме, электронное облако) – ПРИНЦИП НЕОПРЕДЕЛЁННОСТИ ГЕЙЗЕНБЕРГА.
Квантовая теория строения атома
Подтверждённая экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны – корпускулярно-волновой дуализм, побудила учёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой - его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства. (см. состояние электрона в атоме, электронное облако) – ПРИНЦИП НЕОПРЕДЕЛЁННОСТИ ГЕЙЗЕНБЕРГА.
 ВИДЕОРОЛИК https://www.youtube.com/watch?v=OnnmQflUOAw
ВИДЕОРОЛИК https://www.youtube.com/watch?v=OnnmQflUOAw
|
| ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ АТОМА | Электронная конфигурация - формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы Электронная конфигурация обычно записывается для атомов в их основном состоянии. НАПРИМЕР элемента Uuo (унуноктия, в переводе с лат. 1-1-8, стовосемнадцатый) 118, атома периодической системы с самым большим номером будет иметь следующий вид: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f14 6d107p6. |
| СОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ | Состояние электрона в атоме – это информация об энергии электрона и пространстве, в котором он находится.
Электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
 Электрон может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда: где-то больше, где-то меньше. Это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек во всех местах одновременно.
Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии.
Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Электрон может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда: где-то больше, где-то меньше. Это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек во всех местах одновременно.
Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии.
Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
|
| ЭЛЕКТРОННОЕ ОБЛАКО | При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.Электронное облако не имеет резко очерченных границ, и даже на большом расстоянии от ядра существует вероятность пребывания электрона. |
| ЭЛЕКТРОННАЯ ОРБИТАЛЬ | Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90% электронного облака, и это означает, что около 90% времени электрон находится в этой части пространства.
Понятие орбиталь вместо понятия орбита было введено именно для того, чтобы не смешивать движение электрона с движением тела в классической физике.
По форме различают 4 типа орбиталей, которые обозначаются латинскими буквами s, p, d и f.
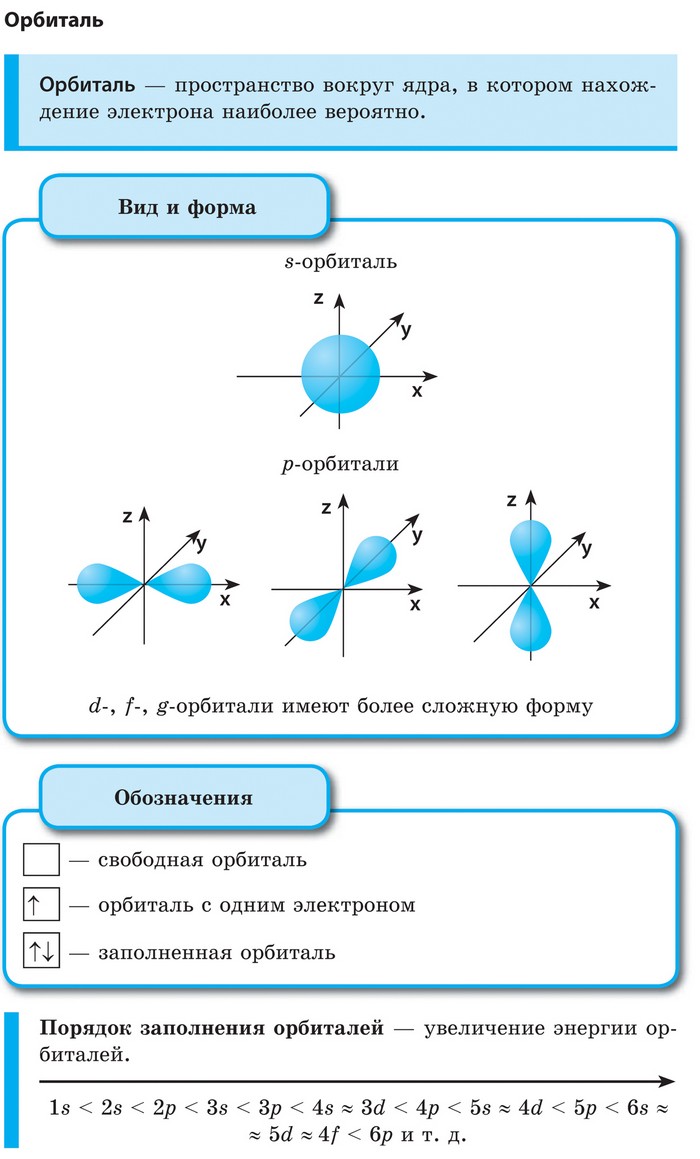
|
| ФОРМЫ ЭЛЕКТРОННЫХ ОБЛАКОВ | Форма электронного облака определяется формой орбитали.
Кроме s, p, d и f- облаков существуют гибридные облака.
При образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация, а «выровненные» орбитали называют гибридными.
Это происходит если атомы формируют свои связи за счет электронов различных подуровней.
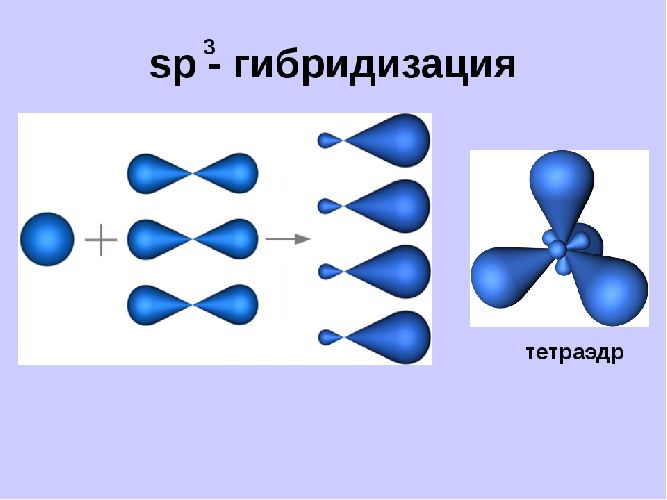 Гибридные облака имеют форму неправильной восьмерки.
Гибридные облака имеют форму неправильной восьмерки.
|
| ЭЛЕКТРОННЫЕ СЛОИ или ЭНЕРГЕТИЧЕСКИЕ УРОВНИ | Характеристикой движения электрона является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, - 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n2
где N – ёмкость энергетического уровня; n - номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором - не более 8; на третьем - не более 18; на четвертом - не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровеньs; второй – дваs, p; третий – триs, p, d;четвертый - четыре подуровняs, p, d, f. Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
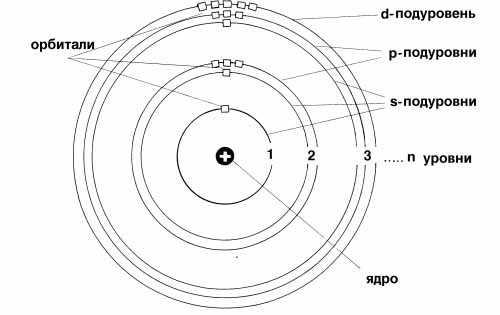
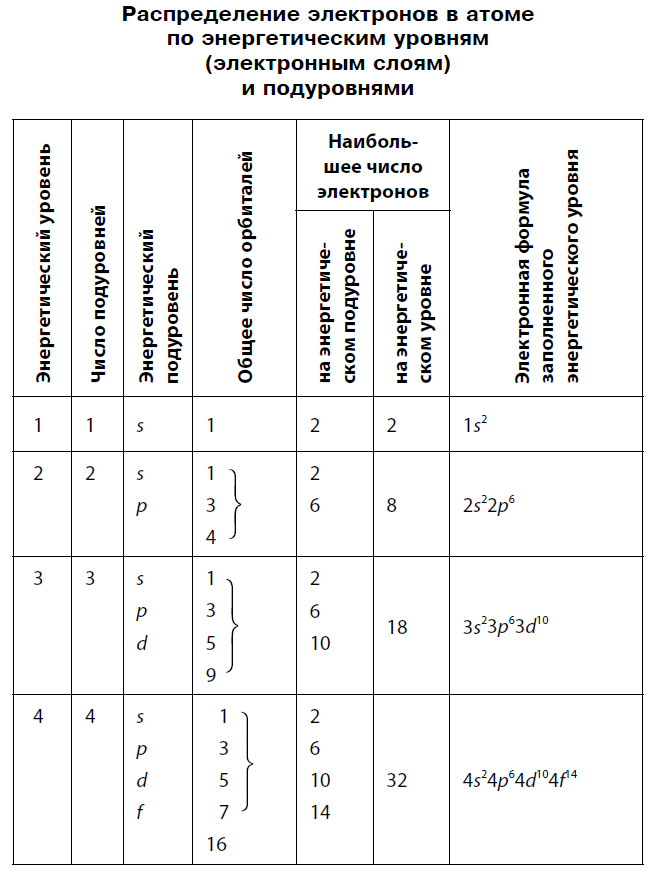
|
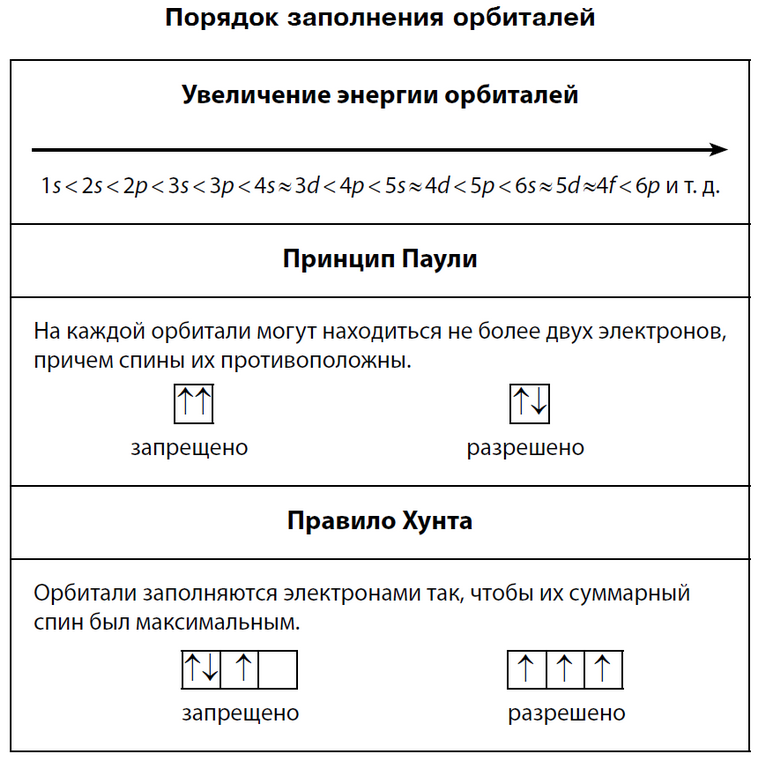
| ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОННЫХ ОРБИТАЛЕЙ | Для определения электронной конфигурации элемента существуют следующие правила:
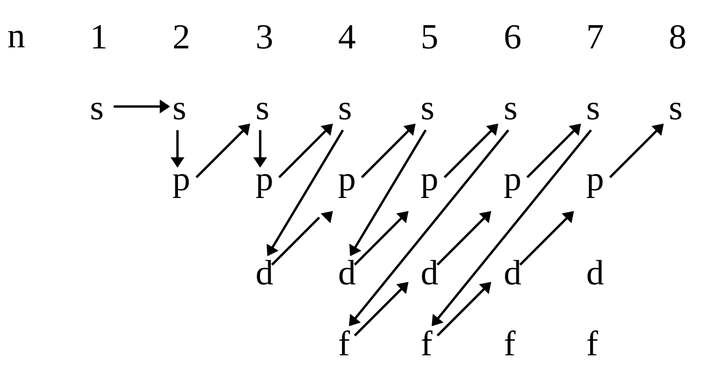
1. Принцип заполнения (правило Клечковского). Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
2. Принцип запрета Паули. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (вращаются вокруг своей оси в разные стороны). Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
3. Правило Хунда. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
Номер периода показывает число энергетических электронных уровней в атоме.
На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
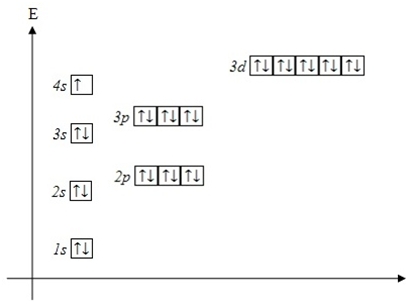
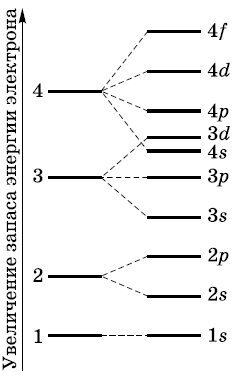  Строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек - записывают графические электронные формулы (или орбитальные диаграммы).
Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному, а лишь затем спариваются.
Строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек - записывают графические электронные формулы (или орбитальные диаграммы).
Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному, а лишь затем спариваются.
|
| ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ | Валентными называются электроны, которые принимают участие в образовании химической связи. Номер группы показывает общее число «валентных» электронов. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне. |
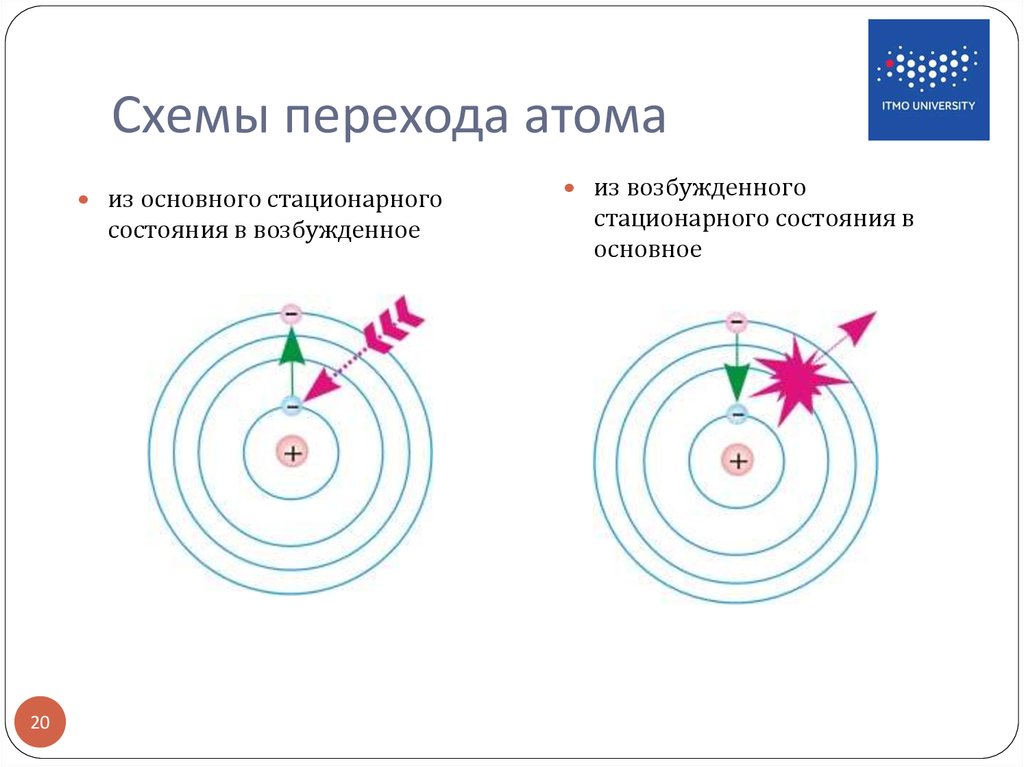
| ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА | Основное состояние- состояние с минимальной энергией. Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице.
Получая энергию извне, переходят в возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Основное и возбужденное состояние атома серы
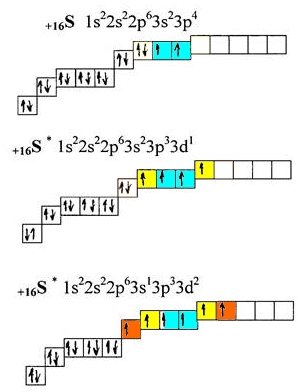
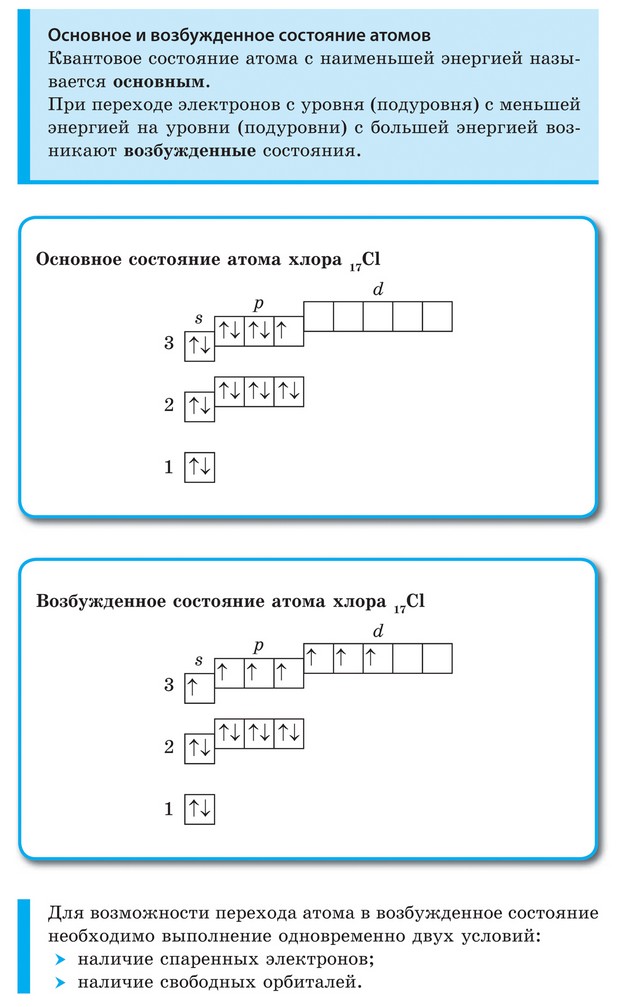
|
| ПРОВАЛ ЭЛЕКТРОНА | У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au происходит “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d,а не 4f.
Распределение электронов в атоме хрома - согласно правилам(сверху) и реальное(снизу), согласно исключениям из правила Клечковского:
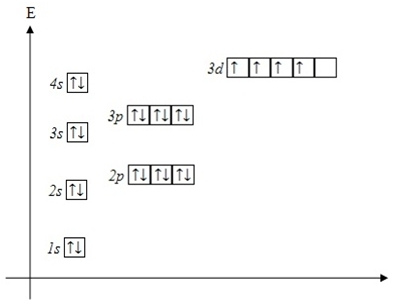 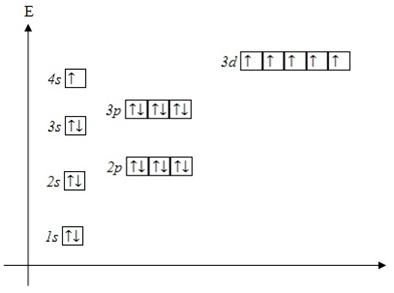 Распределение электронов в атоме меди — согласно правилам(сверху) и реальное(снизу), согласно исключениям из правила Клечковского:
Распределение электронов в атоме меди — согласно правилам(сверху) и реальное(снизу), согласно исключениям из правила Клечковского:
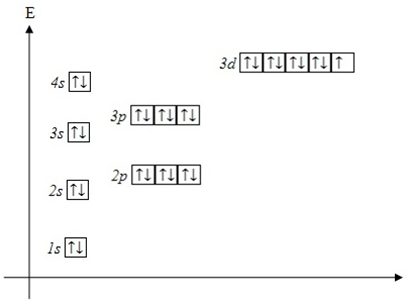 
|
| ЗАВЕРШЕННЫЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ | Уровень считается завершённым, если содержит максимально возможное количество электронов (первый уровень - 2 электрона, второй уровень - 8 электронов, третий уровень - 18 электронов, четвёртый уровень - 32 электрона и т.д.). Незавершённый уровень содержит меньшее число электронов. НЕ ПУТАТЬ! Правило октета (октетная теория) – предложено Г.Н. Льюисом для объяснения причин образования ковалентных связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счёт попарного обобществления своих валентных электронов. Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с внешним электронным уровнем из (s2+p6), т.е. из октета электронов. ПОЭТОМУ Многочисленные попытки химиков заставить благородные элементы вступать в химические реакции увенчались успехом лишь сравнительно недавно: начиная с 60-х годов известно несколько десятков соединений ксенона и криптона с наиболее "агрессивным" из всех химических элементов - фтором, а также с кислородом. Однако до сих пор неизвестно ни одного стабильного соединения гелия, неона и аргона. |
| ЭЛЕКТРОННАЯ ОБОЛОЧКА ИОНОВ | Атомы превращаются в ионы, если отдают и принимают электроны.
Ион калия имеет восьмиэлектронный октет.
Ион хлора имеет восьмиэлектронный октет.
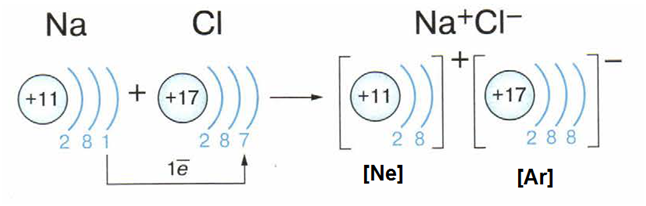 Строение наружного электронной оболочки иона натрия аналогично атому неона, а иона хлора – атому аргона.
Строение наружного электронной оболочки иона натрия аналогично атому неона, а иона хлора – атому аргона.
|
| ЭЛЕКТРОННЫЕ АНАЛОГИ | Химические элементы, у которых имеется одинаковая конфигурация валентных электронов, называются электронными аналогами. У полных аналогов совпадают электронные конфигурации двух последних периодов. Например: 32Ge: 1s2 2s2 2p6 3s23p64s23d104p2 50Sn: ……… ….4s24p65s24d105p2 |
| Кратко: ОСНОВНЫЕ ПОЛОЖЕНИЯ СОВРЕМЕННОЙ ТЕОРИИ СТРОЕНИЯ АТОМА | Электрон имеет двойственную (корпускулярно-волновую) природу, т.е. ведет себя и как частица, и как волна. Как частица, электрон обладает массой и зарядом; как волна, он обладает способностью к дифракции. Для электрона невозможно одновременно точно измерить координату и скорость. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Область пространства, где вероятнее всего находится электрон, называется орбиталью. Ядра атомов состоят из протонов и нейтронов, имеющих общее название - нуклоны. |
| ЭЛЕМЕНТЫ ПЕРВОГО ПЕРИОДА |  Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
 В атоме гелия первый электронный слой завершен - в нем 2 электрона. Водород и гелий - s-элементы; у этих атомов заполняется электронами s-орбиталь.
В атоме гелия первый электронный слой завершен - в нем 2 электрона. Водород и гелий - s-элементы; у этих атомов заполняется электронами s-орбиталь.

|
| ЭЛЕМЕНТЫ ВТОРОГО ПЕРИОДА | У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
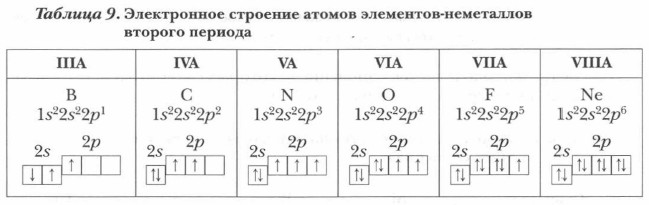 В атоме неона второй электронный слой завершен - в нем 8 электронов.
В атоме неона второй электронный слой завершен - в нем 8 электронов.
|
| ЭЛЕМЕНТЫ ТРЕТЬЕГО ПЕРИОДА | У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s-электронная орбиталь. Na и Mg - s-элементы.
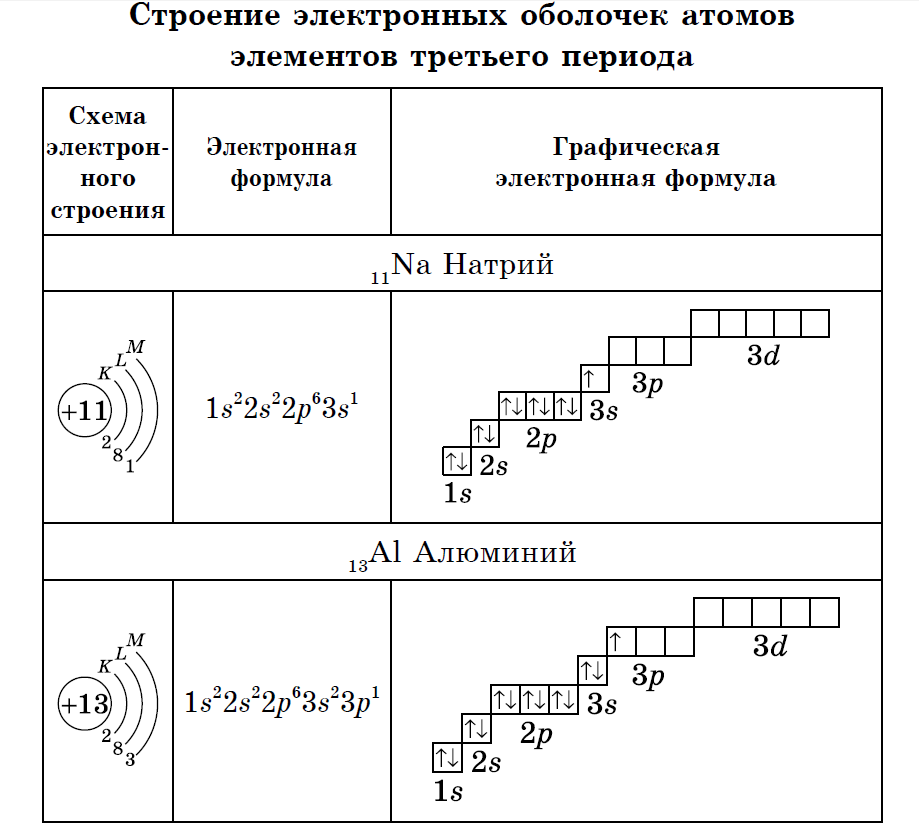 У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar - р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar - р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
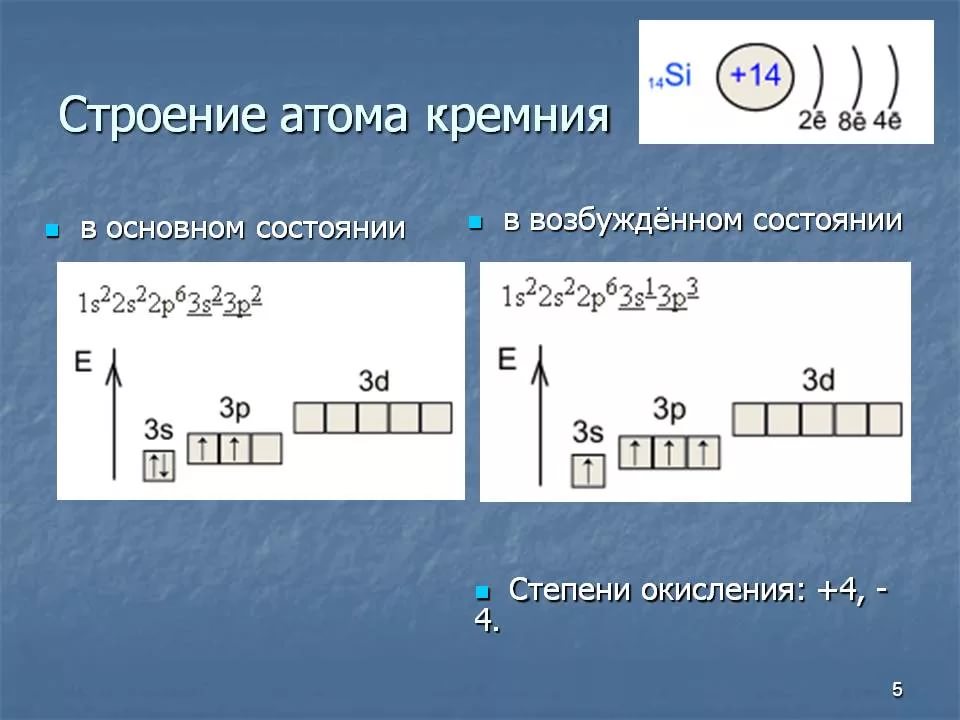

|
| ЭЛЕМЕНТЫ ЧЕТВЕРТОГО ПЕРИОДА | У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т.к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са - s-элементы главных подгрупп. У атомов от Sc до Zn заполняется электронами предвнешний 3d-подуровень. Это 3d-элементы. Их относят к переходным элементам.
В электронных оболочках атомов хрома и меди происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
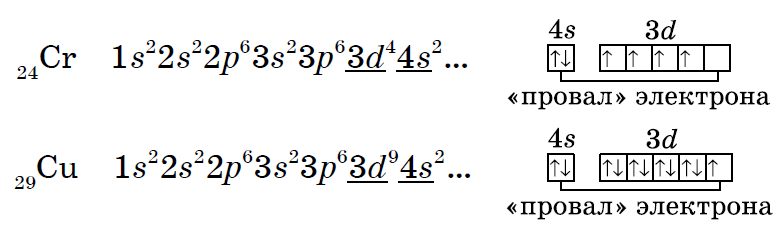 В атоме цинка третий электронный слой завершен - в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr - р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.
В атоме цинка третий электронный слой завершен - в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr - р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.
|
| ЭЛЕМЕНТЫ ПЯТОГО ПЕРИОДА | У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s - 4d - 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42Мо, 44Ru, 45Rh, 46Pd, 47Ag. В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя. 4f-элементы называют лантаноидами. 5f-элементы называют актиноидами. |
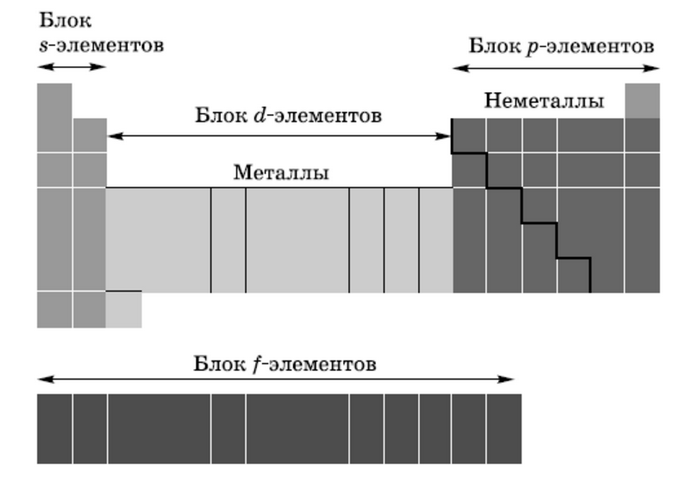
| ЭЛЕКТРОННАЯ КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ | В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
· s-элементы. Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
· p-элементы. Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III-VIII групп.
· d-элементы. Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
· f-элементы. Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|