
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дисциплина (модуль): Биохимия
ЭТАЛОНЫ ОТВЕТОВ
Дисциплина (модуль): Биохимия
Билет № 1
1. Ферменты – биологические катализаторы белковой природы. Раздел биохимии, изучающий структуру ферментов и катализируемые ими реакции, называется энзимологией. Участок молекулы фермента, в котором происходит присоединение субстрата называется активным центром. Ферменты катализируют тысячи химических реакций, из которых, в конечном счете, слагается обмен веществ в клетке. Их отличает:
1) высокая каталитическая эффективность.
2) Специфичность действия. Каждый фермент катализирует конкретную химическую реакцию и при этом не происходит образования побочных продуктов.
3) Регулируемость. Разнообразные вещества могут увеличивать или снижать каталитическую активность ферментов.
4) Способность работать в физиологических условиях: при низких температурах и атмосферном давлении
2. Цитратный цикл (цикл Кребса, цикл трикарбоновых кислот) протекает в матриксе митохондрий.
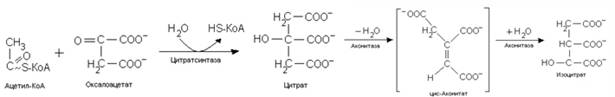
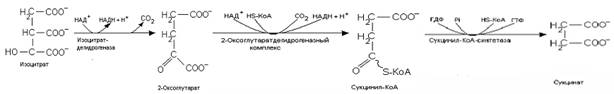
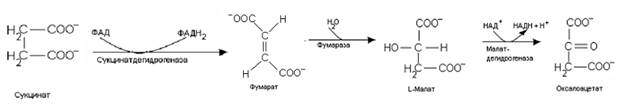
1) Скорость протекания реакций ЦТК зависит от соотношения АТФ/АДФ и НАДН/НАД+. Накопление АДФ и НАД+ приводит к возрастанию скорости его реакций. Ключевыми ферментами цикла являются цитратсинтаза – первый фермент данного метаболического пути, активность которого определяется доступностью оксалоацетата. АТФ и НАДН, а также цитрат ингибируют этот фермент, а АДФ является аллостерическим активатором. Изоцитратдегидрогеназааллостерически активируется АДФ и ионами Са2+ и ингибируется НАДН.
2) Цитратный цикл является амфиболическим процессом, он связывает катаболические и анаболические процессы через общие для них метаболиты. Катаболическаяроль ЦТК заключается в окислении ацетильного остатка до двух молекул СО2 и наработке трех молекул НАДН и одной молекулы ФАДН2, поставляющих протоны и электроны в дыхательную цепь, а также в образовании одной молекулы макроэргического соединения ГТФ.
3) Анаболическая роль ЦТК заключается в том, что из промежуточных метаболитов этого процесса могут синтезироваться другие вещества. Цитрат участвует в переносе ацетил-КоА в цитоплазму для синтеза липидов. Кроме того, цитрат способен связывать ионы кальция и участвовать в процессах его переноса и отложения (минерализации). Из оксалоацетата образуется глюкоза, аспарагиновая кислота, серин, цистеин. Аспарагиновая кислота необходима для синтеза нуклеотидов. Из 2-оксоглутарата может образовываться глутаминовая кислота, из нее глутамин, который также необходим для синтеза нуклеотидов. Сукцинил-КоА участвует в синтезе порфиринов, а также является донором НS-КоА в реакции образования активной формы ацетоацетата при утилизации кетоновых тел.
3. Одним из механизмов инактивации биогенных аминов является их окислительное дезаминирование с образованием альдегида и молекулы аммиака. Эти реакции катализируют моно- (МАО) и диаминооксидазы (ДАО), которые присутствуют во всех органах и тканях живых организмов. Моноаминооксидазы инактивируют первичные, вторичные и третичные амины, а диаминомонооксидазы – путресцин, кадаверин, гистамин и алифатические амины. Коферментом МАО является ФАД, а ДАО – пиридоксальфосфат.
Другим путем инактивации биогенных аминов являются реакции метилирования.
Задача
1) Серповидноклеточная анемия
2) Гемоглобина
3) Замена остатка глутаминовой кислоты на остаток валин в β-цепи гемоглобина
4) Гемоглобин S
5) Гемоглобин S в дезоксигенированном состоянии полимеризуется, что приводит к гемолизу эритроцитов и гипоксии.
Билет № 2
1. Витамин В1 (тиамин). В организме витамин В1 превращается в кофермент тиаминпирофосфат (ТПФ), или тиаминдифосфат (ТДФ). ТПФ является коферментом в реакциях окислительного декарбоксилирования пирувата и 2-оксоглутарата, что определяет его участие в энергетическом обмене. Кроме того, ТПФ является коферментом транскетолазы - фермента неокислительного этапа пентозофосфатного пути превращения углеводов.
Наиболее характерным и специфическим признаком гиповитаминоза В1 являются дегенеративные изменения нервов, приводящие к полиневриту. Заболевание получило название болезнь бери-бери. Кроме того, для гиповитаминоза В1 характерно нарушение сердечной деятельности, а также секреторной и моторной функций ЖКТ. Недостаточность тиамина может сопровождаться психическими расстройствами, потерей памяти на недавние события, склонностью к галлюцинациям
2. В пентозофосфатном пути можно выделить две части – окислительную и неокислительную.
Окислительные реакции пентозофосфатного пути. Ферменты: 1 – глюкозо-6-фосфатдегидрогеназа, 2 – лактоназа, 3 – 6-фосфоглюконатдегидрогеназа, 4 – пентозофосфатизомераза, 5 – пентозофосфатэпимераза.
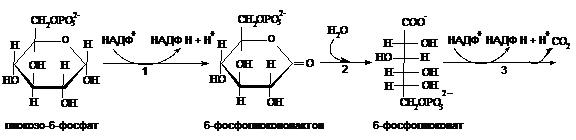

Восстановленный в ходе окисления глюкозы НАДФ используется в восстановительных реакциях синтеза жирных кислот, холестерола и других соединений. Кроме того, молекулы НАДФН необходимы для реакций обезвреживания ряда токсичных веществ, получения пероксида водорода, при фагоцитозе.
Образующийся рибозо-5-фосфат используется в синтезе нуклеотидов, являющихся составными частями нуклеиновых кислот и нуклеотидных коферментов и макроэргов (АТФ, ГТФ).
Пентозофосфатный путь расщепления глюкозы наиболее активно протекает в печени, эритроцитах, лейкоцитах, коре надпочечников и половых железах.
3. Гормональная регуляция в человеческом организме построена в основном по принципу иерархического подчинения. Гормоны гипоталамуса – либерины – стимулируют синтез и секрецию тропных гормонов гипофиза. Тропные гормоны, в свою очередь, стимулируются синтез и секрецию гормонов периферических желез внутренней секреции (ЖВС). Гормоны периферических ЖВС, помимо воздействия на метаболические процессы, влияют на работу гипоталамуса и гипофиза, подавляя секрецию либеринов и тропинов. В том случае, если тропный гормон не воздействует на какую-либо из периферических ЖВС, его секреция подавляется соответствующим статином, секрецию которого повышает данный тропный гормон.
Либерины и статины – гормоны гипоталамуса. Их мишенью является аденогипофиз. Передача сигнала осуществляется по аденилатциклазному и инозитолфосфатному механизмам. Либерины стимулируют, а статины подавляют синтез и секрецию тропных гормонов. В настоящее время известны тиреолиберин, кортиколиберин, гонадолиберин, соматолиберин и соматостатин.
Задача
1) Альбумина
2) Значительное количество отрицательно заряженных остатков глутаминовой и аспарагиновой аминокислот, а также аминокислот с неполярными радикалами
3) Поддержание осмотического давления плазмы крови, перенос ионов металлов и гидрофобных веществ в плазме крови, резерв аминокислот в случае белкового голодания
4) Снижение содержания альбумина приводит к выходу воды ткани
5) Альбумин синтезируется в печени
Билет № 3
1. Четвертичная структура белка – это пространственная структура, состоящая из нескольких полипептидных цепей, обладающих третичной структурой и образующих функционально активную молекулу. Отдельные полипептидные цепи в составе четвертичной структуры называются протомерами или субъединицами. Четвертичная структура характерна не для всех белков. Белки, имеющие четвертичную структуру, называются олигомерными. В поддержании четвертичной структуры участвуют водородные и ионные связи, а также гидрофобные взаимодействия.
Свойства олигомерного белка отличаются от свойств его отдельных протомеров и определяются взаимодействием между ними. Это можно продемонстрировать на примере молекулы гемоглобина. Гемоглобин - тетрамерный белок состоит из двух a-субъединиц и двух b-субъединиц, каждая из которых содержит небелковую часть - гем. Гемоглобин осуществляет транспорт кислорода из легких к тканям. При присоединении кислорода к одной из субъединиц гемоглобина происходит изменение ее третичной структуры, что вызывает целый ряд структурных перестроек в соседних субъединицах. В результате присоединение последующих молекул кислорода к остальным субъединицам происходит с каждым разом все более эффективно. Такое явление называется кооперативным эффектом.
2. Аэробный распад глюкозы – основной путь ее катаболизма. В этом процессе можно выделить следующие стадии: 1) распад молекулы глюкозы до двух молекул пирувата в цитоплазме. Эту стадию иногда также называют аэробным гликолизом; 2) перенос молекул пировиноградной кислоты и восстановленных эквивалентов из цитоплазмы в матрикс митохондрий; 3) в матриксе митохондрий пируват подвергается окислительному декарбоксилированию с образованием молекул ацетил-КоА; 4) молекулы ацетил-КоА включаются в цикл трикарбоновых кислот;5) восстановленные молекулы НАД и ФАД отдают свои электроны в дыхательную цепь. В результате этих превращений в аэробных условиях молекула глюкозы распадается до СО2 и эндогенной воды, а освобождающаяся энергия используется на синтез молекул АТФ.
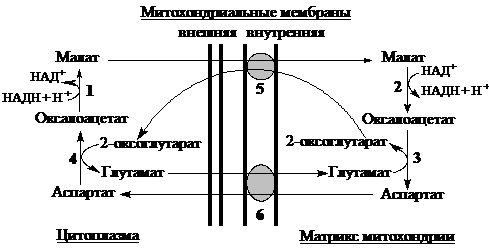
Малат-аспартатный челночный механизм. Ферменты: 1 – малатдегидрогеназа цитоплазматическая, 2 – малатдегидрогеназа митохондриальная, 3 – аспартатаминотрансфераза митохондриальная, 4 – аспартатаминотрансфераза цитоплазматическая, 5 – малат-2-оксоглутараттранслоказа, 6 - аспартат-глутаматтранслоказа.
3. Многочисленные гормоны (первичные посредники), включая адренокортикотропный гормон (АКТГ), антидиуретический гормон (AДГ), гонадотропины, тиреотропный гормон (TТГ), глюкагон, катехоламины (адреналин/ норадреналин) и др. сигнальные молекулы осуществляют передачу сигнала по аденилатциклазному механизму. Рецептор для этих сигнальных молекул располагается в плазматической мембране клеток мишеней и ассоциирован с гуаниннуклеотид-связывающий белок, который называют G-белком. Данный белок состоит из a-, b- и g субъединиц. Если гормон не связан с рецептором, то a-субъединица G-белка связана ГДФ. Образование гормон-рецепторного комплекса сопровождается конформационными изменениями цитоплазматического домена рецептора, которые влияют и на конформацию G-белка. Это приводит к тому, что в a-субъединице G-белка происходит обмен ГДФ на ГТФ, что влечет за собой диссоциацию комплекса и a-субъединица с ГТФ, перемещаясь по мембране латеральной диффузией связывается с молекулой аденилатциклазы и активирует ее. Активная аденилатциклаза катализирует реакцию образования цАМФ из АТФ. цАМФ играет роль вторичного посредника в передаче сигнала, она присоединяется к регуляторным субъединицам протеинкиназы А и активирует ее. Протеинкиназа А осуществляет фосфорилирование белков-мишеней, изменяя тем самым их конформацию и активность. В результате происходит изменение обмена веществ в клетке.
Задача
1) Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но отличающиеся по строению.
2) 5 изоферментов: ЛДГ1 (4Н), ЛДГ2 (3НМ), ЛДГ3 (2Н2М), ЛДГ4 (Н3М) и ЛДГ5 (4М)
3) ЛДГ1
4) Наибольшее количество ЛДГ1 синтезируется в миокарде
5) Инфаркт миокарда
Билет № 4
1. Белки различаются по своим физико-химическим свойствам. Молекулярная масса белков колеблется от 6000 до 1 000 000 Д и выше и зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - от количества протомеров.
По форме молекул белки делят на глобулярные и фибриллярные.
Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис. Степень ионизации этих радикалов зависит от рН среды. В кислой среде уменьшается отрицательный заряда белков, в щелочной – положительный. Значение рН, при котором белок не заряжен, называют "изоэлектрическая точка"и обозначают как pI.
Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Заряженные белки, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Кроме этого, растворимость белка определяется составом растворителя
Выделения индивидуальных белков из биологического материала основано на разнице в их физико-химических свойствах. Высаливание-метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе.
Метод разделения белков с помощью гель-фильтрации основан на том, что вещества, отличающиеся молекулярной массой и формой молекул в разное время вымываются из хроматографической колонки.
Метод электрофореза основан на различной способности белков перемещаться в электрическом поле. Белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду, а катионные белки - к отрицательно заряженному катоду. Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
2. 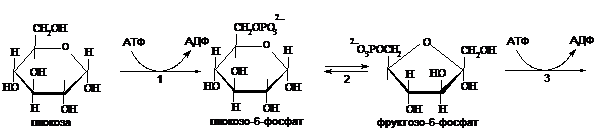

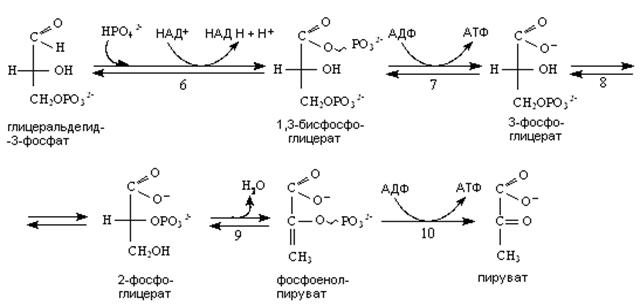
Ферменты: 1 – гексокиназа, 2 – фосфоглюкоизомераза, 3 – фосфофруктокиназа I, 4 – фруктозобисфосфатальдолаза, 5 – триозофосфатизомераза, 6 – глицеральдегидфосфатдегидрогеназа, 7 – фосфоглицераткиназа, 8 – фосфоглицератмутаза, 9 – енолаза, 10 – пируваткиназа.
В результате катаболизма глюкозы до пирувата образуется 2 молекулы АТФ путем субстратного фосфаорилирования в реакциях 7 и 10.
3. Все трансаминазы отличаются по своей специфичности к различнымх аминокислотам. В реакциях трансаминирования участвуют почти все аминокислоты, исключение составляют лизин, треонин и пролин. Наиболее активно трансаминированию подвергаются аланин, глутаминовая и аспарагиновая кислоты. Основными α-кетокислотами, принимающими участие в трансаминировании, являются пируват, оксалоацетат и 2-оксоглутарат. В активном центре трансаминаз коферментом являетсяпиридоксаль-5-фосфат (активная форма витамина В6), прочно связанный с лизином.
Наиболее активны две трансаминазы – аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). Их активность определяют в сяворотке крови для диагностики инфаркта миокарда и заболеваний печени. В норме активность АЛТ и АСТ в сыворотке крови около 40 Е/л, а соотношение АСТ/АЛТ (коэффициент де Ритиса) равно 1,33+0,4. При заболеваниях печени наблюдается резкое повышение активности АЛТ (АСТ/АЛТ<0,6), а при инфаркте миокарда наибольшие изменения выявляются в активности АСТ (АСТ/АЛТ > 2).
Задача
1) Изоферменты – это ферменты, катализирующие одну и ту же реакцию, но отличающиеся по строению.
2) 5 изоферментов: ЛДГ1 (4Н), ЛДГ2 (3НМ), ЛДГ3 (2Н2М), ЛДГ4 (Н3М) и ЛДГ5 (4М)
3) ЛДГ5
4) Наибольшее количество ЛДГ1 синтезируется в печени
5) Гепатит
Билет № 5
1. В реакциях 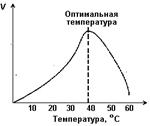 Подобно большинству химических реакций, скорость ферментативных реакций повышается с повышением температуры. Оптимальной температурой для работы большинства ферментов является физиологическая температура человеческого тела 36,6°. При температурах выше 40-45°С активность ферментов начинает снижаться, что связано с тепловой инактивацией и денатурацией структуры белков при высоких температурах.
Подобно большинству химических реакций, скорость ферментативных реакций повышается с повышением температуры. Оптимальной температурой для работы большинства ферментов является физиологическая температура человеческого тела 36,6°. При температурах выше 40-45°С активность ферментов начинает снижаться, что связано с тепловой инактивацией и денатурацией структуры белков при высоких температурах.
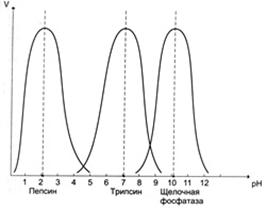
 В большинстве случаев ферменты наиболее активны в узком диапазоне значений рН, отклонение от оптимума сопровождается резким снижением их активности. Чаще всего оптимум рН ферментов организма человека находится в области нейтральных значений рН. Вместе с тем, есть ферменты, оптимум рН которых находится с сильнокислой (пепсин) или щелочной среде (щелочная фосфатаза и др.).
В большинстве случаев ферменты наиболее активны в узком диапазоне значений рН, отклонение от оптимума сопровождается резким снижением их активности. Чаще всего оптимум рН ферментов организма человека находится в области нейтральных значений рН. Вместе с тем, есть ферменты, оптимум рН которых находится с сильнокислой (пепсин) или щелочной среде (щелочная фосфатаза и др.).
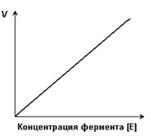
Скорость ферментативной реакции прямо пропорциональна концентрации фермента.
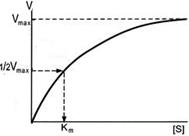 Скорость ферментативной реакции зависит от концентрации субстрата [S]. При постоянной концентрации фермента и низких концентрациях субстрата скорость реакции V практически прямо пропорциональна концентрации субстрата. При высоких концентрациях субстрата скорость реакции V остается постоянной, это максимальная скорость Vмакс. График зависимости скорости реакции от концентрации субстрата характеризуется константой Михаэлиса (Км).
Скорость ферментативной реакции зависит от концентрации субстрата [S]. При постоянной концентрации фермента и низких концентрациях субстрата скорость реакции V практически прямо пропорциональна концентрации субстрата. При высоких концентрациях субстрата скорость реакции V остается постоянной, это максимальная скорость Vмакс. График зависимости скорости реакции от концентрации субстрата характеризуется константой Михаэлиса (Км).
Константа Михаэлиса числено равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. Величина константы показывает сродство фермента к своему субстрату, чем они ниже, тем выше сродство фермента к субстрату и наоборот.
2. Мочевина, или амид угольной кислоты, синтезируется в печени, и представляет собой водорастворимое, нетоксичное соединение, которое выводится почками. Синтез мочевины – это основной способ обезвреживания аммиака у человека.
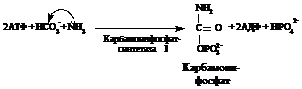
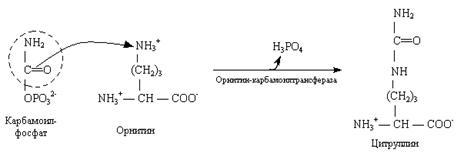
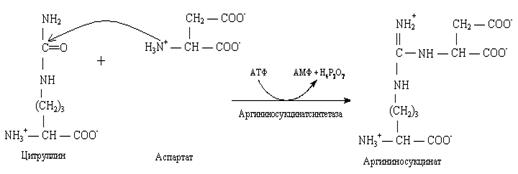
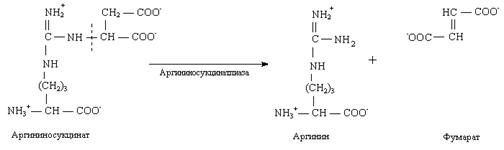
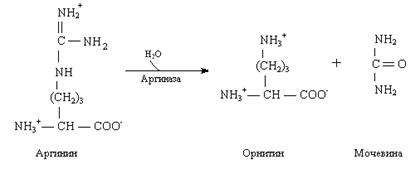
Нарушение синтеза мочевины приводит к гипераммониемии. При почечной недостаточности нарушается выведение мочевины почками.
Это приводит к повышению содержания мочевины в плазме крови – уремии.
3. Мужские половые гормоны – андрогены – являются производными холестерола. Небольшие количества их образуется в коре надпочечников, но основной синтез этих гормонов происходит у мужчин в семенниках. Наиболее активным андрогеном у человека является тестостерон.
Передача сигнала андрогенов в клетки осуществляется по цитозольно-ядерному механизму. Это анаболические гормоны, усиливающие синтез белков, в первую очередь в костной, хрящевой и мышечной тканях. Андрогены усиливают липолиз и β-окисление жирных кислот, синтез нуклеотидов и деление клеток.
Мужские половые гормоны стимулируют развитие половых желез и формирование вторичных половых признаков.
Задача
1) В основном витамины Е и F.
2) Витамина F
3) Полиненасыщенные жирные кислоты линолевая и линоленовая
4) Глицерофосфолипидов
5) Глицерофосфолипиды необходимы для транспорта холестерина в плазме крови и поступления его печень
Билет № 6
1. Аллостерическая регуляция – это регуляция активности фермента под действием присоединения низкомолекулярного эффектора.
Такой тип регуляции свойственен ферментам, в структуре которых, помимо активного центра, есть еще один центр, называемый аллостерическим. К аллостерическому центру присоединяется эффектор при помощи нековалентных связей. Это приводит к конформационным изменениям в структуре всей молекулы, в результате чего каталитическая активность фермента либо увеличивается, либо снижается. Соответственно, эффекторы могут быть либо активаторами, либо ингибиторами.
2. Инсулин, секретируемый b-клетками поджелудочной железы, снижает концентрацию глюкозы в крови, повышая скорость процессов, утилизирующих глюкозу: гликолиза, синтеза гликогена, пентозофосфатного пути распада глюкозы.
Глюкагон и катехоламины оказывают разное действие на гепатоциты и мышечные клетки. Они не оказывают влияния на активность ферментов гликолиза в мышцах, а в печени через образование неактивной фосфорилированной формы пируваткиназы ингибируют гликолиз, при этом глюконеогенез активируется. Синтез гликогена эти гормоны ингибируют, а в печени стимулируют мобилизацию гликогена. Таким образом данные гормоны повышают уровень глюкозы в крови.
Экспрессию генов, кодирующих ферменты глюконеогенеза, вызывают гормоны коры надпочечников – глюкокортикоиды. Типичный их представитель кортизол. В мышцах он усиливает распад белка, а в печени активирует метаболизм аминокислот и последующий из них синтез глюкозы. Это также способствует повышению содержания глюкозы в плазме крови.
3. 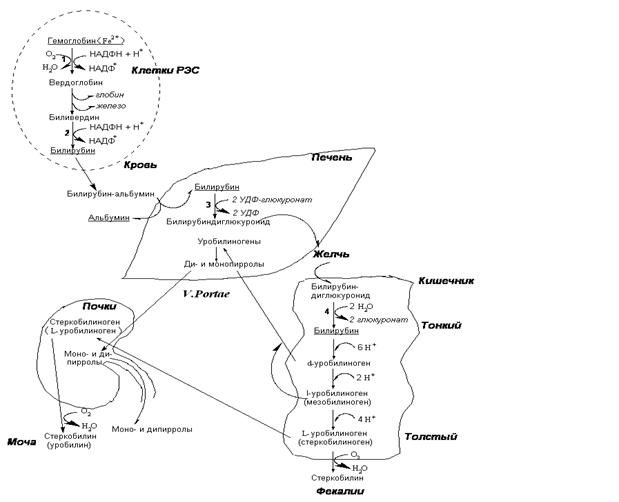 Распад гемоглобина. Цифрами на схеме обозначены ферменты: 1 – гемоксигеназа; 2– биливердинредуктаза; 3– УДФ-глюкуронилтрансфераза; 4– b-глюкуронидаза; РЭС – ретикуло-эндотелиальная система.
Распад гемоглобина. Цифрами на схеме обозначены ферменты: 1 – гемоксигеназа; 2– биливердинредуктаза; 3– УДФ-глюкуронилтрансфераза; 4– b-глюкуронидаза; РЭС – ретикуло-эндотелиальная система.
Конечный продукт распада гема – билирубин – практически нерастворим в воде. Он в комплексе с альбумином транспортируется в печень, где продвергается конъюгации с глюкуроновой кислотой. Конъюгированный билирубин растворим в воде и легко выводится с желчью в кишечник.
Задача
1) Витамина D
2) Синтез витамина D3 происходит в коже под действием ультрафиолета
3) 7-дегидрохолестерол
4) 1,25-дигидроксихолекальциферол и 24, 25-дигидроксихолекальциферол
5) Эти активные формы участвую в регуляции уровня ионов кальция и фосфатов в плазме крови, оказывая влияние на формирование костной ткани
Билет № 7
1. Белки имеют несколько уровней пространственной конформации. Вторичная структура - это пространственная укладка полипептидной цепи молекулы белка, которая образуется за счет водородных связей между СО и NH группами пептидного остова. Вторичная структура может быть регулярной и нерегулярной. Существует два основных вида регулярной вторичной структуры белка: a-спираль и b-складчатый лист. Последний называют также b-структурой или b-слоем.
Третичная структура белка – это пространственная структура, которая поддерживается за счет связей и взаимодействий между радикалами удаленных аминокислот. В формировании третичной структуры принимают участие водородные, ионные связи, дисульфидные мостики между радикалами цистеина, а также гидрофобные взаимодействия между неполярными радикалами аминокислот. Наиболее распространенный вид третичной структуры – это глобула.
2. Процесс b-окисления условно делят на 3 этапа:
1) активация жирных кислот в цитозоле и их транспорт в митохондрии;
2) собственно процесс окисления;
3) окисление ацетильной группы образующегося ацетил-КоА в ЦТК и сопряжённых цепях переноса электронов.
Активация жирной кислоты:

Активированные жирные кислоты не могут самостоятельно проникнуть внутрь митохондрий, поэтому их перенос осуществляет специальная транспортная система, включающая карнитин-ацилтрансферазы I и II и транслоказу. Перенос ацилов осуществляется в виде ацил-О-карнитина.
Реакции β-окисления насыщенной жирной кислоты в матриксе митохондрий:
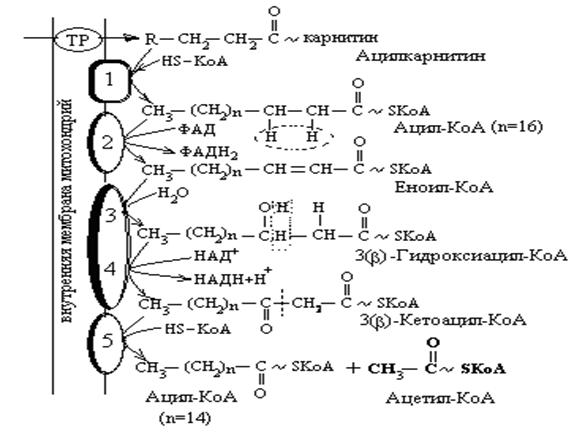
Ферменты: 1. Карнитин-ацил-трансфераза II; 2. Ацил-КоА-дегидрогеназа; 3. 2,3 -Еноил-КоА-гидратаза; 4. 3(b)-Гидроксиацил-КоА-дегидрогеназа; 5. Ацил-КоА-ацетилтрансфераза (кетотиолаза). TP – транслоказа.
Реакции повторяются до тех пор, пока не образуется четырехуглеродное соединение – ацетоацетил-КоА, который в свою очередь расщепляется β-кетоацилтиолазой до двух молекул ацетил-КоА. На этом процесс окисления жирной кислоты завершается. Конечные продукты – ацетил-КоА, НАДН и ФАДН2 окисляются в общих путях катаболизма, что позволяет синтезировать большое количество молекул АТФ.
3. Транспорт кислорода в крови осуществляет гемоглобин – гемопротеин эритроцитов. Это белок, состоящий из четырех протомеров, каждый из которых содержит гем. В легких молекула кислорода присоединяется к гемовому железу в степени окисления +2, железо при этом не окисляется, а молекула гемоглобина изменяет свою конформацию таким образом, что последующие молекулы кислорода присоединяются значительно легче.
В тканях в результате катаболических процессов образуется углекислый газ, который под действием карбоангидразы эритроцитов превращается в угольную кислоту. При диссоциации угольной кислоты образуются катионы водорода Н+ и бикарбонат-анионы НСО32-. Большая часть углекислого газа транспортируется кровью к легким в виде бикарбонатов, а небольшое количество его присоединяется по аминогруппам к молекуле гемоглобина. В легких карбоангидраза катализирует обратную реакцию, и углекислый газ выделяется с выдыхаемым воздухом. Катионы водорода, присоединяясь к молекуле гемоглобина, снижают его сродство с кислородом и способствуют поступлению кислорода в ткани.
Различают две основных формы гемоглобина взрослого человека А и А2. В период внутриутробного развития синтезируются фетальный и эмбриональный гемоглобины, обладающие более высоким сродством к кислороду по сравнению с гемоглобинами взрослого человека.
Гемоглобинопатии – это наследственные патологии структуры гемоглобинов. Наиболее известна серповидно-клеточная анемия, при которой в результате точечной мутации синтезируется гемоглобин S. Этот гемоглобин обладает пониженным сродством к кислороду и, его молекулы в дезокси-форме образуют агрегаты, не приспособленные к транспорту кислорода. При талассемиях не происходит синтез одного из типов протомеров гемоглобина – α или β. Сродство такого гемоглобина к кислороду также снижено.
Задача
1) Рибофлавина (В2)
2) ФАД (флавинадениндинуклеотид). ФМН (флавинмононуклеотид)
3) В окислительно-восстановительных реакциях
4) Участие в энергетическом обмена (ЦТК, ЦТД, β-окисление жирных кислот), в процессах обезвреживания токсических веществ
5) С оксидоредуктазами
Билет № 8
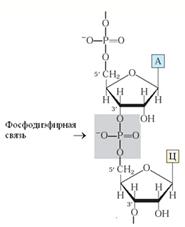 1. Нуклеиновые кислоты - это полимеры, мономерами которых служат нуклеотиды, соединенные фосфодиэфирными связями. Существует два вида нуклеиновых кислот ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). ДНК является носителем генетической информации, она обеспечивают ее хранение и в основном локализована в ядре. Кроме того, существует и митохондриальная ДНК, кодирующая небольшое число белков этой органеллы. РНК обеспечивает реализацию генетической информации, то есть участвует в синтезе белка. Мономер нуклеиновых кислот, нуклеотид, состоит из трех компонентов: неорганического фосфата, сахара пентозы и азотистого основания. В рибонуклеотидах сахаром служит b-D-рибоза, а в дезоксирибонуклеотидах - b-D-дезоксирибоза.
1. Нуклеиновые кислоты - это полимеры, мономерами которых служат нуклеотиды, соединенные фосфодиэфирными связями. Существует два вида нуклеиновых кислот ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). ДНК является носителем генетической информации, она обеспечивают ее хранение и в основном локализована в ядре. Кроме того, существует и митохондриальная ДНК, кодирующая небольшое число белков этой органеллы. РНК обеспечивает реализацию генетической информации, то есть участвует в синтезе белка. Мономер нуклеиновых кислот, нуклеотид, состоит из трех компонентов: неорганического фосфата, сахара пентозы и азотистого основания. В рибонуклеотидах сахаром служит b-D-рибоза, а в дезоксирибонуклеотидах - b-D-дезоксирибоза.
Первичная структура нуклеиновых кислот - это последовательность нуклеотидов в полинуклеотидной цепи, соединенных 3¢-5¢-фосфодиэфирными связями, которые образуются между пентозой одного нуклеотида и фосфатом другого.
2. Часть молекул ацетил-КоА, образующиеся в ходе β-окисления жирных кислот в печени, превращается в два важных метаболита - ацетоацетат и 3(β)–гидроксибутират. Процесс синтеза этих метаболитов называется кетогенезом, а сами вещества получили название кетоновых тел.
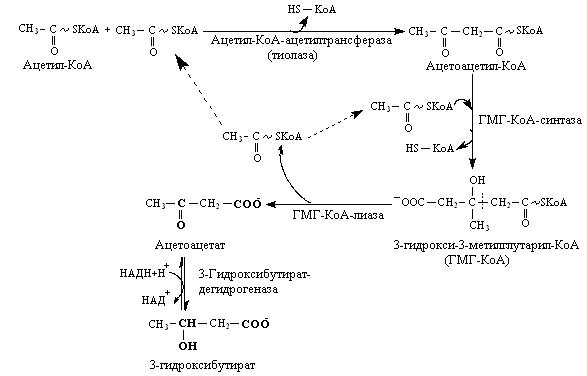
Кетоновые тела из печени попадают в кровь и легко проникают через цитоплазматические мембраны клеток сердечной и скелетной мышц, коркового слоя почек и других тканей, где они служат источником энергии. Клетки мозга могут использовать кетоновые тела для получения энергии только при длительном голодании.
3. Продукты неполного восстановления кислорода (O2) получили название активных форм кислорода (АФК). При одноэлектронном восстановлении кислорода происходит образование реакционноспособного супероксидного анион-радикала (О2  ):
):
О2 + ē → О2 
Супероксидный анион-радикал, принимая еще один ē, превращается в пероксидный анион (О22-), полное протонирование которого приводит к образованию перекиси водорода (Н2О2). К АФК относят также гидроксильный радикал, синглетный кислород, оксид азота, гипохлорит-анион, пероксинитрит-анион.
АФК инициируют свободно-радикальное окисление различных биомолекул, в том числе и перекисное окисление фосфолипидов биомембран. Перекисное окисление полиненасыщенных жирных кислот (ПОЛ) начинается с отщепления атома водорода от -СН2-, расположенного между двойными связями (остаётся неспаренный электрон у атома углерода). Образовавшийся свободный радикал -СН• присоединяет молекулу кислорода и превращается в пероксидный радикал жирной кислоты (LOO•). Пероксиды не стабильны, и распадаются с образованием конечных продуктов ПОЛ.
В результате ПОЛ нарушается избирательная проницаемость мембран. Образовавшиеся в результате ПОЛ сшивки нарушают текучесть мембраны и снижают скорость латеральной диффузии и перемещения компонентов мембраны между слоями. Такие мембраны не могут полноценно выполнять свои функции.
Задача
1) Никотинамид (ниоцин, никотиновая кислота, РР)
2) НАД+ (никотинамидадениндинуклеотид) и НАДФ+ (никотинамиддинуклеотидфосфат)
3) В окислительно-восстановительных реакциях
4) НАД+ - основной кофермент энергетического обмена, НАДФ+ участвует в восстановительных биосинтезах (синтез липидов, тимидиловых нуклеотидов), в микросомальном окислении, антиоксидантной защите, фагоцитозе
5) Пеллагра
Билет № 9
1. В поддержании пространственной структуры белка значительную роль играют слабые связи и взаимодействия, которые легко нарушаются при изменении внешних условий. Лабильность структуры белка – это способность претерпевать конформационные изменения под действием различных физико-химических факторов.
Денатурация - нарушение третичной и вторичной структуры белка, приводящее к утрате его биологических функций и физико-химических свойств.При этом не происходит разрушение первичной структуры белка, образованной прочными пептидными связями.
Денатурацию белка вызывают различные физико-химические факторы, такие как высокая температура, резкое изменение рН среды, органические растворители, соли тяжелых металлов, гуанидин хлорид, мочевина. Эти вещества называют денатурирующими агентами.
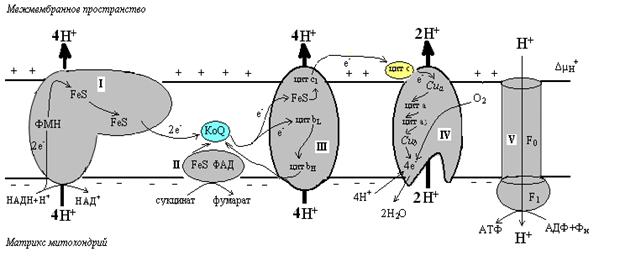
2. Энергетическое обеспечение аэробных клеток эукариот осуществляется, главным образом, за счет окислительного фосфорилирования, которое осуществляется в дыхательной цепи (цепи переноса электронов, ЦПЭ). Дыхательная цепь локализована во внутренней мембране митохондрий и представляет собой сложным полиферментным ансамблем. В процессе работы дыхательной цепи происходит транспорт электронов (восстановительных эквивалентов) от НАДН и ФАДН2междукомплексами дыхательной цепи и конечное акцептирование их молекулярным кислородом. Энергия переносимых электронов расходуется на выкачивания протонов из матрикса в межмембранное пространство, что приводит к возникновению трансмембранного электрохимического потенциала (градиента протонов, Δµн+). Энергия электрохимического потенциала может использоваться для образования АТФ из АДФ и неорганического фосфата в АТФ-синтазе, которая также локализована в внутренней мембране митохондрий. Такой способ синтеза АТФ называется окислительным фосфорилированием. Кроме того, энергия трансмембранного потенциала протонов может использоваться на выработку тепла и транспорт ионов через мембрану митохондрий. Дыхательная цепь включае 5 комплексов: НАДН-убихинон-редуктазой (Комплекс I), сукцинат-убихинон-редуктазой (Комплекс II), убихинон-цитохром с-редуктазой (Комплекс III), цитохром с-оксидазой (Комплекс IV) и F0-F1-АТФ-синтазой (Комплекс V). Комплексы I—IV образуют цепь переноса электронов, а Комплекс V осуществляет синтез АТФ.
3. Отличительная особенность катаболизма пуринов у человека состоит в окислении пуринового цикла без нарушения его целостности.
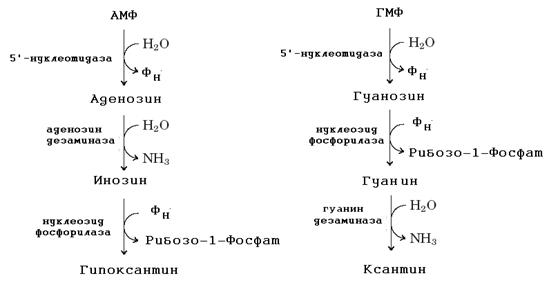
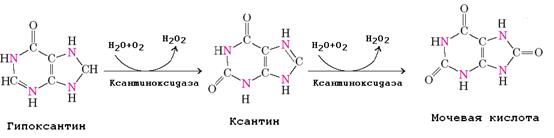
Мочевая кислота плохо растворима в воде и при ее избыточном образовании возникает заболевание подагра.
Задача
1) Кобаламин (В12)
2) Метилкобаламин и дезоксиаденозилкобаламин
3) Метилкобаламин участвует в реакции трансметилирования, дезоксиаденозилкобаламин в реакциях изомеризации
4) Метилкобаламин участвует в реакции регенерации метионина, дезоксиаденозилкобаламин – в катаболизме жирных кислот с нечетным количеством углеродных атомов и обмене аминокислот с разветвленной углеводородной цепью
5) При атрофическом гастрите в обкладочных клетках слизистой оболочки желудка снижается синтез с внутреннего фактора Касла, который необходим для всасывания В12
Билет № 10
1. Одно из характерных свойств ферментов – их высокая специфичность. Специфичностью называют способность фермента катализировать определенный тип химической реакции и взаимодействовать с определенными субстратами. Каждый фермент действует либо на одно вещество, либо на группу родственных по структуре веществ. Соответственно, субстратная специфичность ферментов может быть абсолютной и относительной. Под термином абсолютная специфичность подразумевается способность фермента катализировать превращение одного единственного субстрата. Наивысшей степенью абсолютной субстратной специфичности является стереоспецифичность, когда фермент может осуществлять каталитическое превращение только одного из стереоизомеров вещества. Чаще ферменты катализируют превращение сходной по строению группы субстратов, то есть проявляют относительную (или групповую) субстратную специфичность. Такие ферменты, как правило, действуют либо на определенную химическую группу, либо на определенный тип химических связей.
2. Холестерол – стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза – печень.


Выделяют три основных механизма регуляции ГМГ-КоА-редуктазы:
1) В качестве репрессора синтеза ГМГ-КоА-редуктазы выступает экзогенный холестерол. Холестерол и желчные кислоты по механизму обратной отрицательной связи выступают в роли аллостерических ингибиторов ГМГ-КоА-редуктазы и вызывают конформационные изменения этого фермента, способствующие его протеолизу.
2) Иодтиронины и эстрогены индуцируют синтез ГМГ-КоА-редуктазы.
3) Адреналин или глюкагон фосфорилирование ГМГ-КоА-редуктазы, переводя ее в неактивную форму. Для проявления активности ГМГ-КоА-редуктазы необходимо ее дефосфорилирование, которое в свою очередь активируется инсулином.
3. Сигнальные молекулы гидрофобной природы могут проникать в клетку через плазматическую мембрану. Рецептор для таких молекул, как правило, располагается внутри клетки. В зависимости от вида сигнальной молекулы он может находиться в цитозоле или в ядре. В любом случае гормон-рецепторный комплекс будет действовать на генетическом уровне, связываясь с регуляторными последовательностями ДНК и влияя на транскрипцию генов.
Наиболее хорошо изучен механизм действия глюкортикостероидов, которые регулируют экспрессию специфических генов клеток-мишеней на уровне инициации транскрипции. Глюкокортикостероидные гормоны легко проходят через липидный бислой в цитоплазму клетки, где взаимодействуют со своими рецепторами. В отсутствие гормона глюкокортикоидный рецептор находится в неактивном состоянии в комплексе с белками шаперонами. При взаимодействии гормона с рецептором проис
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|