
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Разбор ошибок по тестам на Решу ЕГЭ:
Разбор ошибок по тестам на Решу ЕГЭ:
1) «Гидролиз (Задание №23) - вариант 4165515
2) Электролиз (Задание №22) – вариант № 4165499»
(Сдало 6 человек - Спасибо вам большое, что цените мой труд! И простите, пожалуйста, за задержку разбора)
Методичка для повторения теории по электролизу и гидролизу! https://docs.google.com/document/d/1Ti1QIct8H-Q9xcSKxA4BwcR-k70-0bzscMOwSofDh60/edit?usp=sharing
!!!Очень порадовали, потому что по электролизу ошибок очень мало (всего 3 в сумме у всех кто решал)!!!
Электролиз. Задание №22
№4.

Ошибка была в пункте Б – ошибка было в том, что выбрали ответ Б-5, но запомните (об этом в пособии оговорено отдельно), что если у нас катион алюминия в составе соли, то на катоде в ходе электролиза ВСЕГДА выделяется ВОДОРОД (как у щелочных металлов), потому что алюминий ДЛЯ ЭЛЕКТРОЛИЗА - АКТИВНЫЙ металл - не забывайте это!
№5 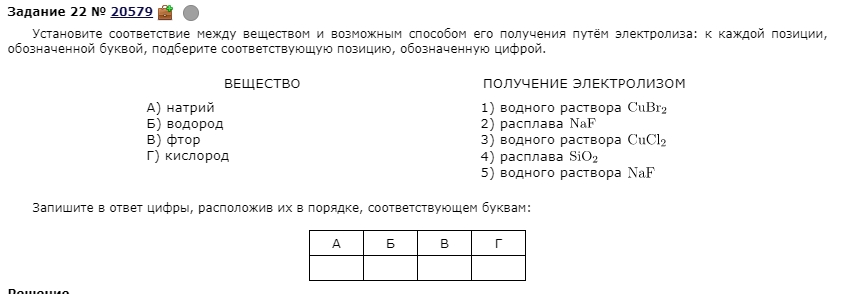
Ответ:2525
Ошибка №1 была допущена в пункте А:
Натрий и остальные щелочные и щелочноземельные металлы мы никогда не получим, если раствор, потому что если катион у нас будет = щМе, то будет электролиз воды, где мы получим на катоде водород, а металл мы не получим.
Чтобы получить электролизом щМе нужно обязательно взять расплав соли.
Ошибка №2 была допущена в пункте Г:
Все, кто ошибся получали кислород из оксида кремния, но к сожалению, из расплава оксида мы ничего не получим.
Кислород получается у нас при окислении воды на аноде, а она окисляется, когда у нас проводится электролиз РАСТВОРА соли, образованной кислородсодержащей кислотой или фтороводородом то есть молей с анионами, например, SO42-, F-, NO3- и др.)
№8. 
Ошибка в пункте Г - кто-то выбирал пункт 5), но важно помнить, что пусть это РАСТВОР соли или гидроксида (неважно), где катион – это щелочной или щелочноземельный металл, то при электролизе выделяется на катоде Водород, а не металл.
| Ошибки по ГИДРОЛИЗУ они однотипные, поэтому давайте просто посмотрим правила гидролиза: |
1 правило: Запоминаем, что все Нерастворимые основания, в таблице растворимости (металл + ОН-) стоит Н, СЛАБЫЕ!
2 правило: Учим сильные и слабые кислоты (табличка есть также, как и все правила и случаи гидролиза в моей методичке – в начале документа есть ссылка).
| Сильные кислоты | Слабые кислоты |
| H2SO4; HCl; HBr; HNO3; HI; HClO4; HClO3; HBrO3; HMnO4 | H2SO3; H2CO3; HNO3; H3PO4; HF; H2S; H2SiO3; HClO; HClO2+ все органические кислоты |
3 правило: Помним, что гидролиз идет ПО СЛАБОМУ, а среду определяем ПО СИЛЬНОМУ (все случаи гидролиза также в методичке).
4 правило: НЕРАСТВОРИМЫЕ СОЛИ НЕ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУ! (на этом многие допустили кучу ошибок =( )
| Теперь перейдем к нашим любимым исключениям: |
1. Ca(OH)2, Sr(OH)2 - в табл. растворимости - малорастворимы, но СИЛЬНЫЕ основания (сильные щёлочи).
2. NH4OH - растворимое основание в таблице растворимости, но СЛАБОЕ ОСНОВАНИЕ.
3. AgOH - в таблице растворимости не существует, условно для ЕГЭ - СИЛЬНОЕ основание!
В таблице растворимости нет, но CsOH и RbOH и Sr(OH)2,Ba(OH)2 , но запомните - это ЩЁЛОЧИ! Они находятся в одной группе с щелочными и щелочноземельными металлами и образуют ЩЁЛОЧЬ - СИЛЬНОЕ основание!
Be(OH)2 - амфотерный гидроксид, проводим аналогию, видим что тоже самое что и с алюминием, что и с цинком, значит Нерастворимое основание, значит СЛАБОЕ основание!
4. H3PO4 - кислота средней силы, но для ЕГЭ и гидролиза - СЛАБАЯ.
| Перейдём к конкретным задания (разберем разные типы без конкретных заданий) |
№1. Установите соответствие между формулой соли и характером среды её разбавленного водного раствора.
Важный вопрос в таких типах заданий: «Как понять какая исенно среда сильнокислая(щелочная) или слабо»?
Тайна фокуса Гудини ПРОСТА: смотрим на выделенные в условие задания слова - думаем или запоминаем- В РАЗБАВЛЕННОМ чём-нибудь Сильного быть НЕ может. ВСЁ СЛАБОЕ! Слабокислое или слабощелочное - определяем по условиям задания).
Ссылка на РЕШУ ЕГЭ, чтобы потренироваться в определение среды раствора солей : (копируем полностью 4 строки!)
https://chem-ege.sdamgia.ru/search?keywords=1&cb=1&search=4.1.3%20Определение%20характера%20среды%20водных%20растворов%20веществ.%20Индикаторы
№2 Установите соответствие между названием соли и характером среды её водного раствора. КИСЛЫЕ СОЛИ
№2.1
А) гидросульфат натрия - сильное основание и сильная кислота, гидролиза нет, есть только диссоциация соли на ионы в водном растворе: NaHSO4 = Na+ + H+ + SO42- у нас есть протон=атом водорода в растворе, поэтому среда кислая.
Исходим из того, что если бы у нас была средняя соль того же сильного основания и сильной кислоты Na2SO4, то среда была бы нейтральная.
Если рассматривать чисто механически в этом случае, то просто сопоставляем два уравнения
NaHSO4 = Na+ + H+ + SO42-
Na2SO4 = Na+ + SO42-
Вычеркнули одинаковые ионы и видим оставшийся протон в первом уравнении, то есть среда уже точно не нейтральная, а раз плавает Н+, значит кислая.
№2.2
А) гидрокарбонат калия - сильное основание + слабая кислота - среда смотрится по СИЛЬНОМУ, значит среда Щелочная
Б) гидрофосфат натрия - сильное основание и слабая кислота (аккуратнее с этой кислотой) - среда щелочная
Г) дигидрофосфат натрия - сильное основание + слабая кислота (НО у нас уже 2 атома водорода, поэтому у нас идет и гидролиз и диссоциации соли в водном растворе, а именно аниона H2PO4- = H+ + HPO42-, появляется наш протон, который как раз нам даёт КИСЛУЮ среду) - эта соль ДЛЯ ЗАПОМИНАНИЯ!
Попробуем структурировать, что есть и предположить что может быть:
| Каким основанием и какой кислотой образована КИСЛАЯ соль? (МеНn(анион)) | Процесс | Среда |
| Сильное основание + сильная кислота | Диссоциация | кислая |
| Сильное основание + слабая кислота | Гидролиз по аниону | Щелочная (смотрим по сильному) |
| дигидрофосфат натрия - сильное основание+ слабая кислота (ИСКЛЮЧЕНИЕ) | Гидролиз по аниону + диссоциация в водном в растворе | Кислая (ЗАПОМНИТЬ!!!) |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|