
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Законы термодинамики. U = Q +A - первый закон термодинамики. Применение законов термодинамики. Изобарный процесс
Законы термодинамики
Процессы теплообмена и совершения работы сопровождаются изменением внутренней энергии системы ΔU. Изменение ΔU внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил A и количества теплоты Q, переданного системе:
ΔU = Q +A - первый закон термодинамики
Q = ΔU + Aʹ
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Закон сохранения энергии: В изолированной системе А=0 , система не обменивается теплотой с окружающими телами Q=0, Внутренняя энергия изолированной системы сохраняется.
А и Q характеризуют изменение внутренней энергии системы в результате того или иного процесса
Применение законов термодинамики
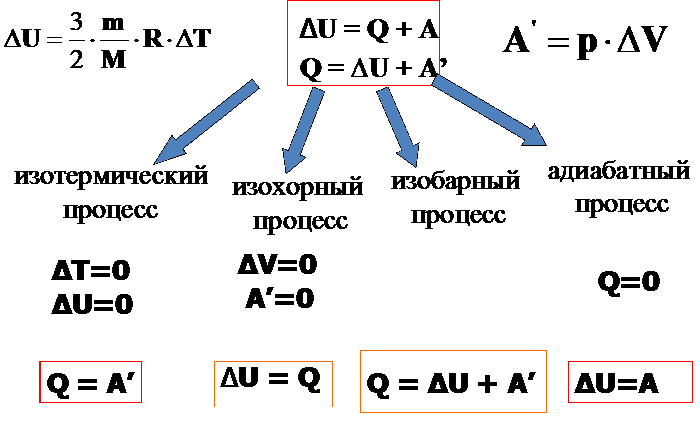
- Изохорный процесс
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Q = ΔU =U(T2) – U(Т1).
Здесь U(T1) и U(T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры. При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
2. Изобарный процесс
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
A = p(V2 – V1) = pΔV
Первый закон термодинамики для изобарного процесса дает:
Q =U(T2)–U(T1)+p(V2–V1)=ΔU+pΔV
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|