
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Расчет газообразного топлива». Топливо. Воздух. Продукты горения. Количество воздуха требуемого на горение.. Продукты горения.. Составляем материальный баланс.. Приход = ∑топлива + ∑расхода
Московский Государственный Вечерний Металлургический Институт
Кафедра Теплотехники и Экологии
Работа по Теплотехнике:
«Расчет газообразного топлива»
Вариант 11
Группа МТ-08
Выполнила ЛонскийC.Л.
Проверил Воителев В.В.
Москва, 2011г
Дается: Определить:
Состав природного газа: Qн ргор=?
СH4 -91% tрас =?
С2H4 -3,0% tдейст=?
С2H6 -1,0% Vд=?
N2 -2,0% Vв=?
CO2 -1,0%
H2O-2,0%
Расчет на 100 м3
nт=1,0
nф=1,03
Расчет:
1. Для газообразного топлива теплота сгорания определяется как сумма произведений тепловых эффектов составляющих горючих газов на их количество:
Известно, что воздух в основном состоит из кислорода и азота. Определяем расход воздуха на горение. В расчетах принимаем следующий состав воздуха: N2 - 79%, O2 - 21%
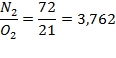
. В воздухе содержится по массе — 23% кислорода и 77% азота, по объему — 21% кислорода и 79% азота.
Следовательно, содержание азота в воздухе превышает содержание кислорода по массе в N2/02=77/23 = 3,34 раза, а по объему в 79/21=3,76 раз
Топливо
Воздух
Всего
Продукты горения
Всего
∑О2∙3,762