
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ca5(P04)3F + IOHNO3 = ЗН3Р04 + 5Ca(N03)2 + HF
СЛОЖНЫЕ УДОБРЕНИЯ НА ОСНОВЕ АЗОТНОКИСЛОТНОГО РАЗЛОЖЕНИЯ ФОСФАТНОГО СЫРЬЯ
Впервые идея о целесообразном разложении фосфатного сырья азотной кислотой была высказана Д.Н. Прянишниковым в 1908 г. Однако реализация этой идеи стала возможной значительно позже, когда резко возросло производство азотной кислоты из синтетического аммиака.
Процесс разложения природного фосфатного сырья азотной кислотой происходит по реакции
Ca5(P04)3F + IOHNO3 = ЗН3РО4 + 5Ca(N03)2 + HF.
Выделяющийся фтористый водород взаимодействует с двуокисью кремния с образованием фтористого кремния, последний с фтористым водородом образует кремнефтористую кислоту. В результате разложения фосфатного сырья азотной кислотой в вытяжке содержится большое количество нитрата кальция. Последний является крайне нежелательной примесью в готовом удобрении, так как очень гигроскопичен и ухудшает физические свойства получаемого сложного удобрения.
Кроме этого, высокое содержание кальция в фосфорной кислоте приводит к переходу фосфора в труднодоступную для растений форму. Поэтому для получения сложных удобрений на основе азотнокислотного разложения фосфатного сырья важно вывести из системы избыток кальция, т.е. снизить отношение СаО : Р2О5. В этой технологии производства сложных удобрений используется тонко-измельченный апатитовый концентрат и 47-55%-я азотная кислота. Схемы образования сложных удобрений различаются по способу выделения из раствора избыточного кальция (рис.5.6).
1. Производство нитрофоски по схеме с вымораживанием избытка
нитрата кальция
При частичном вымораживании кальциевой селитры и выделении ее из раствора с последующей обработкой его аммиаком при одновременной упарке образуется смесь, содержащая фосфаты аммония, дикальцийфосфат и аммиачную селитру:
Н3РО4 + Ca(N03)2 + NH3 = NH4H2P04 + CaHP04 + NH4NO3.
Добавление к такой смеси хлористого или сернокислого калия приводит к получению нитрофоски, состоящей из трех основных питательных элементов: азота, фосфора и калия. Конечной продукцией производства являются нитрофоска и кальциевая селитра.
Эта нитрофоска может содержать 40-50% питательных веществ. Схема дает возможность изменять соотношение питательных веществ в любых комбинациях и позволяет получать гранулированное удобрение, в котором до 60% общего количества Р205
растворимо в воде. Для получения нитрофоски, содержащей 50-60% водорастворимого фосфора, по этому методу из раствора необходимо вывести 70% СаО в виде Са(МОз)2 • 4Н2О. Это удобрение высокоэффективно во всех районах, где растения испытывают недостаток в азоте, фосфоре и калии.
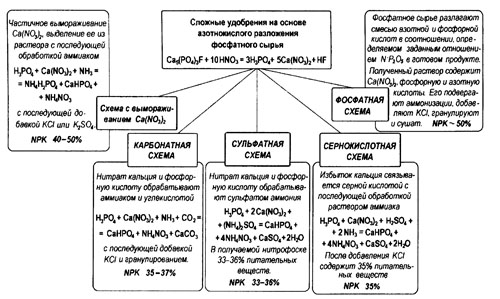
Рис. 5.6. Схемы образования сложных удобрений, различающиеся по способу выделения из раствора избыточного кальция
2. Производство нитрофоски связыванием избытка кальция углекислотой (карбонатная схема)
Н3РО4 + Ca(N03)2 + NH3 + С02= СаНР04 + NH4NO3 + СаСОэ.
При обработке нитрата кальция и фосфорной кислоты аммиаком и углекислотой получается смесь, в состав которой входят дикальцийфосфат, аммиачная селитра и углекислый кальций. После смешивания с хлористым калием смесь без выделения солей кальция гранулируют, сушат, разделяют на фракции и дробят. Карбонатная нитрофоска содержит 35-37% питательных веществ. Эта схема наиболее экономична по производству. Однако с агрохимической точки зрения выпускать карбонатную нитрофоску в гранулированном виде нецелесообразно, так как фосфор в ней находится в цитратно-растворимой форме. Если карбонатную нитрофоску выпускать в порошке, то она может быть использована для основного внесения.
3. Производство нитрофоски и нитрофосов связыванием избытка кальция сульфатом аммония (сульфатная схема)
По этой схеме нитрат кальция и фосфорную кислоту обрабатывают раствором сульфата аммония. В зависимости от нормы сульфата аммония может быть получен продукт с различным содержанием водорастворимой Р2О5. Чтобы иметь тройное удобрение, в смесь добавляют калийсодержащий компонент.
Если вместо сульфата аммония используется сульфат калия, то последний растворяют в азотной кислоте и полученным раствором обрабатывают фосфатное сырье. Суспензия нейтрализуется аммиаком, продукт гранулируется и сушится. В настоящее время нитрофоска с 33-36%-м содержанием питательных веществ производится главным образом этим способом.
4. Производство нитрофоски связыванием избытка кальция серной кислотой (сернокислотная схема)
При связывании избытка кальция серной кислотой в процессе азотно-кислотного разложения фосфатов с последующей обработкой раствора аммиаком образуется смесь, которая после добавления хлористого калия перерабатывается в готовый продукт - нитрофоску, содержащую 35% питательных веществ. Избыток кальция, связанный серной кислотой, находится в удобрении в виде балластной примеси сульфата кальция.
Способ дает возможность изменять соотношение питательных веществ в довольно широких пределах и позволяет выпускать продукт, в котором до 50-60% Р2О5 находится в водорастворимой форме. Существенный недостаток метода - расход дефицитной серной кислоты, превращаемой после связывания с кальцием в балласт.
5. Производство нитрофоски связыванием избытка кальция фосфорной кислотой (фосфатная схема)
Фосфатное сырье разлагают смесью азотной и фосфорной кислот в соотношении, определяемом заданным отношением N : P20s в готовом продукте и содержанием водорастворимого фосфора. Полученный раствор после разложения состоит в основном из Ca(N03)2 и свободных фосфорной и азотной кислот. Его подвергают аммонизации, при которой почти все количество СаО раствора переходит в дикальцийфосфат. Далее добавляют хлористый кальций, гранулируют и сушат.
Главное достоинство этой нитрофоски - высокое содержание питательных веществ и водорастворимой фосфорной кислоты. Содержание каждого из элементов (N, Р205 и К2О) достигает 17%, доля растворимой Р205 - 80%.
Особенностью нитрофосок и нитрофосов является наличие водорастворимого фосфора (не более 50-60% от усвояемого). Это не снижает их агрономической эффективности по сравнению с эквивалентным набором полностью водорастворимых удобрений. Сейчас нитрофоски широко используются как основное удобрение под многие сельскохозяйственные культуры, а также при локальном внесении, особенно под картофель. Нитрофосы используют как основное удобрение под зерновые и кормовые культуры, а также на лугах и пастбищах, хорошо обеспеченных калием.
Технология производства нитрофосок (нитрофосфатов), основанная на разложении фосфатного сырья азотной кислотой или ее смесью с другими кислотами, широко используется в зарубежных странах, где существует недостаток серосодержащего сырья. Основными производителями таких удобрений являются Германия, Австрия и Франция. В Германии выпускают нитрофоски без хлоридов, некоторые из них содержат магний. Во Франции производят большой ассортимент нитрофосок, предназначенных под различные культуры. Под виноград и плодовые культуры выпускают бесхлорную нитрофоску.
В последние годы разработаны способы получения нитрофосок с 80-95% Р2О5 в водорастворимой форме, среди которых наиболее распространен норвежский способ, при котором фосфорит обрабатывают избыточным количеством азотной кислоты с последующей кристаллизацией нитрата кальция при температуре -50°С. Этим способом или его вариантом производят нитрофосфаты в России, Англии, Германии, Франции и Нидерландах. Например, во Франции разработана технология получения 54 видов нитрофосок с соотношением в них азота от 8 до 20%, Р205 - от 7 до 35% и К20 - до 29%.
Азотнокислотная переработка фосфатов заключается в разложении фосфатов азотной кислотой и последующей переработке образующегося раствора (вытяжки), содержащего нитрат кальция и свободную фосфорную кислоту. В зависимости от метода переработки, вытяжки можно получать как односторонние азотные и фосфорные удобрения, так и сложные, двойные или тройные удобрения с самым широким диапазоном соотношения питательных веществ 28-32.
Разложение фосфатов азотной кислотой является сложным процессом, протекающим согласно следующему основному уравнению33-35:
Ca5(P04)3F + IOHNO3 = ЗН3Р04 + 5Ca(N03)2 + HF
Содержащиеся в фосфатах примеси — карбонаты кальция и магния, окислы железа, алюминия и редких земель и фторид кальция также взаимодействуют с азотной кислотой с образованием нитратов:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|