
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Железо, его соединения
Железо, его соединения
Железо является элементом побочной подгруппы VIII A группы. Поэтому его электронное строение отличается от строения электронных оболочек элементов главных подгрупп. Так как железо расположено в 4 периоде, то атомы его имеют четыре энергетических уровня, к тому же заполняется у него сначала не внешний, а предвнешний энергетический уровень. В ядре атома железа содержится 26 протонов. На внешнем энергетическом уровне у атома железа находится два электрона, а на предвнешнем – 14.
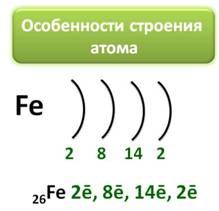
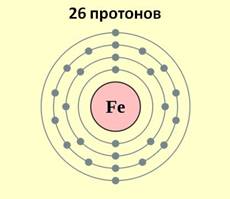
Железо имеет на внешнем энергетическом уровне два электрона, является металлом, поэтому, как и все металлы, он отдаёт электроны и проявляет восстановительные свойства. Если атом железа отдаёт два внешних электрона, тогда он приобретает степень окисления +2, к тому же электрон с предвнешнего уровня тоже может оторваться, тогда степень окисления становится +3.

Рассмотрим железо, как простое вещество.
· блестящий серебристо-белый металл
· имеет температуру плавления 1539 0С
· тугоплавкий металл
· плотность железа 7,87 г/см3
· тяжёлый металл
· железо пластичное и ковкое, поэтому легко обрабатывается
· обладает способностью намагничиваться и размагничиваться.
По распространённости в земной коре железо занимает четвёртое место и второе среди металлов (после алюминия). Его массовая доля в земной коре составляет четыре целых шестьдесят пять сотых процента.

Железо образует ряд минералов:
· магнитный железняк, или магнетит Fe3O4
· красный железняк, или гематит Fe2O3
· бурый железняк, или лимонит 2 Fe2O3 ∙ 3 H2O
· большое значение имеет и железный колчедан, или пирит FeS2 который используют при производстве серной кислоты
· в природных и некоторых минеральных водах встречается гидрокарбонат железа – Fe(HCO3)2
Вообще, различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, содержащую 0,02 – 0,04 % углерода, а также небольшое содержание кислорода, серы, азота и фосфора. Химически чисто железо содержит 0,01 % примесей.
Из технически чистого железа сделаны канцелярские скрепки, кнопки, но оно легко корродирует.


Химически чистое железо, напротив, почти не корродирует. Вот почему железная колонна в Дели, построенная ещё в пятнадцатом веке не ржавеет, потому что она сделана из чистого железа.

С железом человек знаком очень давно. Считается, что первое железо было метеоритного происхождения. В переводе с древнего шумерского языка «железо» ― это «капнувший с неба, небесный». В настоящее время зафиксировано около пятисот железных метеоритов. Самый крупный железный метеорит массой шестьдесят тонн найден более семидесяти лет назад в Юго-Западной Африке, второй по величине – массой тридцать тонн – столетием раньше в Гренландии.



Алхимики обозначали железо в виде копья и щита, которые символизировали бога войны Марса.

Для современного человека железо играет огромную роль, ведь именно оно составляет основу техники и машиностроения. Железо как никакой другой металл способен изменять свои технические характеристики в результате легирования и специальной обработки. В настоящее время известно очень много сплавов этого металла, отличающихся разнообразием свойств:
· устойчивые в морской воде
· выдерживающие действие высоких температур и агрессивных сред
· мягкие для производства проволоки
· жёсткие для производства пружин
· магнитные и немагнитные.
Широко используются чугун и сталь. Оксид железа (III) используется как пигмент в производстве красок (охра).
Железо можно получить восстановлением из железных руд углеродом (коксом), оксидом углерода два, водородом, алюминием, то есть пирометаллургическим способом.

Изучая химические свойства железа, следует учитывать, что оно может иметь степень окисления +2 и +3. Это всё зависит от окислительной способности тех веществ, с которыми реагирует железо.
Железо реагирует с простыми и сложными веществами. Однако оно малоактивно при обычных условиях.
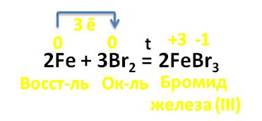
Например, в реакции с галогенами (кроме йода) железо образует галогениды, в которых его степень окисления его +3. В реакции с бромом каждый атом железа отдаёт по 3 электрона молекуле брома. При этом образуется бромид железа (III), где степень окисления железа +3, а брома – -1. В этой реакции железо выступает в роли восстановителя, а бром – в роли окислителя.
В реакции с серойжелезо образует сульфид железа (II), в котором степень окисления железа +2, а серы – -2. В данной реакции каждый атом железа отдаёт по 2 электрона молекуле серы. Причём, железо является восстановителем, а сера – окислителем.

А вот в реакции железа с кислородом, образуется железная окалина, состоящая из оксидов железа (II) и (III). В этой реакции 3 атома железа отдаёт 8 электронов молекуле кислорода, выступая в роли восстановителя, а кислород – в роли окислителя.
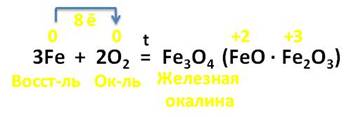
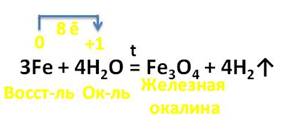
Железо реагирует и со сложными веществами.
Например, с парами воды железо реагирует при нагревании, при этом образуется опять железная окалина и выделяется водород. Здесь также три атома железа отдают 8 электронов ионам водорода, железо является восстановителем, а ионы водорода – окислителем.
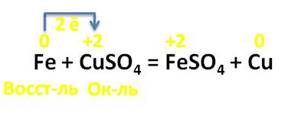
Железо взаимодействует с растворами солей, оно вытесняет металлы, которые стоят правее его в электрохимическом ряду напряжений металлов. Например, в реакции с раствором сульфата меди (II), железо вытесняет медь. В этой реакции железо повышает свою степень окисления с 0 до +2, а медь, наоборот, понижает свою степень окисления с +2 до 0. Каждый атом железа отдаёт по 2 электрона ионам меди. Железо выступает в роли восстановителя, а медь – в роли окислителя.
С растворами кислот железо также реагирует. Например, в реакции с разбавленной соляной кислотой железо окисляется до соли железа со степенью окисления железа +2. Эту реакцию можно наблюдать наглядно: для этого следует налить в пробирку раствора соляной кислоты и поместить туда кусочек железа, при этом можно наблюдать выделение пузырьков газа. Это выделяется водород. Причём ещё образуется и соль – хлорид железа (II).
В уравнении реакции каждый атом железа отдаёт по два электрона ионам водорода. Железо изменяет свою степень окисления с 0 до +2, при этом является восстановителем, а водород понижает свою степень окисления с +1 до 0 и ионы водорода являются окислителем.

А концентрированная серная и азотная кислоты не реагируют с железом, потому что они пассивируют его, образуя на поверхности металла прочную оксидную плёнку.

У железа со степенью окисления +2 есть ряд соединений. Например, FeO – оксид железа (II) и гидроксид железа два. Прямой реакцией получить гидроксид железа два из оксида железа два невозможно, нужно сначала получить соль железа, а только потом гидроксид.
Осуществим следующие превращения: получим хлорид железа (II) из железа, затем из хлорида железа (II) получим гидроксид железа (II), а потом и оксид железа (II).
Для того, чтобы получить хлорид железа (II) в первой стадии, необходимо, чтобы железо прореагировало с разбавленной соляной кислотой, затем к хлориду железа (II) следует добавить щёлочь, например, гидроксид натрия. Таким образом, мы получим гидроксид железа (II), а прокаливая нерастворимое в воде основание гидроксид железа (II), мы сможем получить и оксид железа (II).
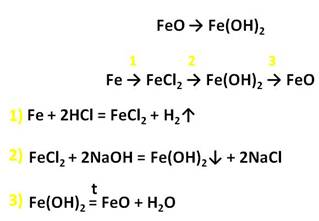
Оксид и гидроксид железа (II) обладает ярко выраженными основными свойствами и реагируют с кислотами. В результате данных реакций образуются соли железа, в которых степень окисления железа +2.

Оксид железа (II) представляет собой порошок чёрного цвета. Его получают восстановлением оксида железа (III) оксидом углерода (II).

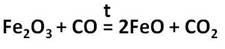
Ионы железа легко окисляются кислородом воздуха или другими окислителями до иона железа +3. Из-за этого окисления зелёный осадок гидроксида железа (II) превращается в гидроксид железа (III) бурого цвета.
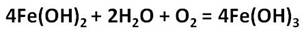
Железо образует и соединения со степенью окисления +3. Это оксид и гидроксид железа (III), которые получают также косвенным путём. Например, осуществим превращения: получим хлорид железа (III) из железа, затем из хлорида железа (III) следует получить гидроксид железа (III), а потом оксид железа (III).
Для получения хлорида железа (III), нужно, чтобы в реакцию вступило железо с хлором, затем к хлориду железа (III) добавим щёлочь – гидроксид калия и получим гидроксид железа (III), при нагревании этот гидроксид образует оксид железа (III) и воду.
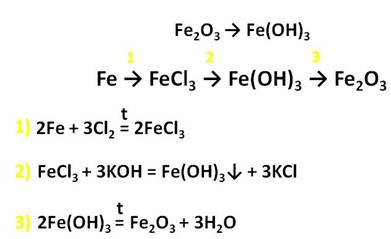
Оксид железа (III) – Fe2O3 – порошок бурого цвета, его получают разложением гидроксида железа (III).

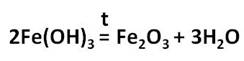
Оксид и гидроксид железа (III) проявляют слабовыраженные амфотерные свойства и легко реагируют с кислотами, в результате чего образуются соли железа, в которых его степень окисления +3.
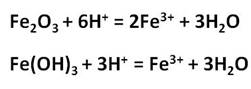
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании с образованием ферритов: в результате взаимодействия оксида железа (III) с гидроксидом натрия, образуется феррит натрия, в результате взаимодействия гидроксида железа (III) с гидроксидом натрия, образуется также феррит натрия.
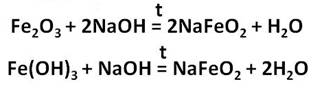
Получим гидроксиды железа (II) и (III) и исследуем их свойства. Для этого, нальём в две пробирки соль железа – хлорида железа (II) и хлорида железа (III). А затем добавим в каждую из них раствора щёлочи, после чего мы можем наблюдать выпадение осадков: в первой пробирке осадок белого цвета, который становится сразу зелёного цвета, а во второй – осадок бурого цвета. Однако со временем, осадок в первой пробирке начинает приобретать бурую окраску за счёт окислительных процессов. Если добавить к этим двум осадкам раствора серной кислоты, то осадок растворяется и в первой и во второй пробирке.
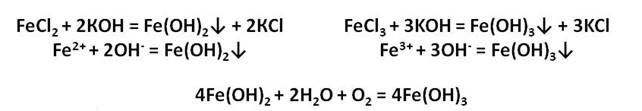
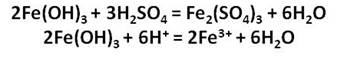
Соли железа имеют большое значение. Так кристаллогидрат сульфата железа (II) FeSO4 ∙ 7H2O, или железный купорос используется для борьбы с вредителями растений и при приготовлении минеральных красок, а также для обработки древесины.



Для распознавания соединений железа (II) и (III) проводят качественные реакции на эти ионы. Так, качественной реакцией на ион железа (II) служит реакция с красной кровяной солью, а реактивом на ион железа (III) является жёлтая кровяная соль. Если к соединениям железа (II) и (III) добавить соответственно красной и жёлтой кровяной соли, то в обоих случаях образуется синий осадок.

Для обнаружения ионов железа (III) можно использовать и роданид калия или аммония. При этом образуется раствор кроваво-красного цвета.
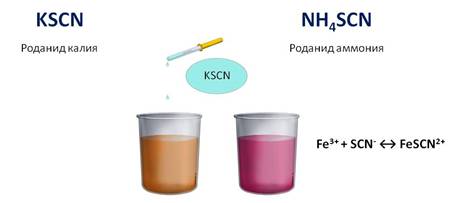
Роль железа в жизнедеятельности очень велика. Массовая доля железа в животных организмах составляет около одной сотой процента. В организме человека содержится около пяти г железа, главным образом в составе гемоглобина, фермента каталазы. Соединения железа применяют при лечении малокровия, истощении, упадке сил. Суточная потребность человека в железе составляет около пятнадцать тысячных грамма. Железо содержится в шпинате, салате, капусте, чёрной смородине, мясе, сливовом соке, кураге, изюме, семечках тыквы и подсолнуха, чёрном хлебе и других продуктах.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|