
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Семинар по теме: «Химия элементов I,IIА-групп»
Семинар по теме: «Химия элементов I,IIА-групп»
Вопросы и задачи
Вопросы
1. Опишите способы получения элементов I,IIА-групп в промышленности и в лаборатории.
2. Опишите способы получения оксидов, пероксидов, надпероксидов элементов IА-группы. Сравните их термическую устойчивость. Как влияет соразмерность катиона и аниона на прочность кристаллической решетки и, как следствие, на устойчивость соединений?
3. Опишите способы получения оксидов и пероксидов элементов IIА-группы в лаборатории.
4. Бинарные соединения: получение нитрида магния в лаборатории.(лаб. журнал)
5. Опишите способы получения гидроксидов s-элементов в лаборатории. Как меняется их термическая устойчивость и растворимость при движении вниз по группам. Дайте обоснованный ответ.
6. Почему гидроксид магния в отличие от гидроксида бериллия растворяется в концентрированном растворе хлорида аммония? Опишите химизм процесса. Рассчитайте константу равновесия данного процесса.(лаб. журнал)
7. Опишите, почему происходит окрашивание пламени спиртовки при внесении в ее пламя солей щелочных и щелочноземельных металлов? (лаб. журнал)
Ответы и решения к вопросам и задачам
Вопрос 1. Опишите способы получения щелочных и щелочно-земельных металлов в промышленности и в лаборатории
| Металл | Получение | |
| В промышленности | В лаборатории | |
| Na | 1. Электролиз расплава хлорида натрия: 2NaCl(расплав) = 2Na + Cl2 Для понижения температуры плавления вводят CaCl2 Исторический метод: сплавление карбоната натрия с углем: Na2CO3 + 2C = 2Na↑ + 3CO | 1. Термическое разложение азида натрия: 2NaN3 = 2Na↑ + 3N2↑ |
| Li | 1. Электролиз расплава: 2LiCl(расплав) = 2Li + Cl2 Для понижения температуры плавления добавляют KCl | 1. Взаимодействие оксида лития с кремнием в присутствии оксида кальция: 2Li2O + Si + 2CaO = 4Li + Ca2SiO4 Получить литий термическим разложением азида нельзя, т.к. литий образует на воздухе устойчивый нитрид |
| K | 1. Действие паров натрия на расплав хлорида или гидроксида калия: KCl(расплав) + Na(г.) = NaCl(расплав) + K(г.) 2. Метод Грейсхейма: сплавление фторида калия с карбидом кальция: 2KF + CaC2 = CaF2 + 2C + 2K↑ | 1. Термическое разложение азида калия: 2KN3 = 2K + 3N2 |
| Rb, Cs | 1. Восстановление хлоридов металлов кальцием: 2MCl + Ca = 2M + CaCl2 (M = Rb, Cs) | 1. Восстановление карбонатов металлов цирконием: 2CsCO3 + Zr = ZrO2 + 2CO2 + 4Cs↑ |
| Mg | 1. Прокаливание доломита и последующее восстановление оксида коксом или феррокремнием: CaCO3∙MgCO3 = CaO + MgO + 2CO2 2MgO + 2CaO + FeSi = 2Mg↑ + Ca2SiO4 + Fe↑ Далее производят отгонку магния. | |
| Ca-Ba | 1. Электролиз расплава исходных хлоридов: MCl2(расплав)= M + 2Cl2 4CaO + Al = 3Ca + CaAl2O4 | |
Вопрос 2. Опишите способы получения оксидов, пероксидов, надпероксидов элементов IА-группы. Сравните их термическую устойчивость. Как влияет соразмерность катиона и аниона на прочность кристаллической решетки и, как следствие, на устойчивость соединений?
| Кислородные соединения | Получение |
| M2O (оксиды): Na2O, K2O, Rb2O | 1. Термическое разложение пероксидов соответствующих металлов в вакууме: M2O2(тв.) = M2O(тв.) + 0,5O2↑ 2. Взаимодействие щелочного металла с нитратом данного металла: 10K + 2KNO3 = K2O + N2↑ 3. Взаимодействие азидов щелочных металлов с нитратами соответствующих щелочных металлов: 5NaN3 + NaNO3 = 3Na2O + 8N2 Удобным способом получения Na2O является взаимодействие металлического натрия с твердым гидроксидом натрия: 2NaOH + 2Na = 2Na2O(тв.) + H2↑ |
| M2O2 (пероксиды): Li2O2, K2O2 | 1. Взаимодействие пероксида водорода со спиртовым раствором гидроксида лития 2LiOH + H2O2 = Li2O2 + 2H2O (C2H5OH) 2. Термическое разложение надпероксида калия в вакууме: 2KO2(тв.) = K2O2(тв.) + O2↑ |
| MO2 (надпероксиды): NaO2 | 1. Пропускание кислорода через металлический натрий при высоком давлении: Na + O2 = NaO2 |
| MO3 (озониды): KO3, RbO3, CsO3 | 1. Взаимодействие озона с пероксидами соответствующих металлов: MO2(тв.) + O3 = MO3 + O2 2. Взаимодействие озона с гидроксидами соответствующих металлов в присутствии водоотнимающего агента: 4MOH(тв.) + 4O3 = 4MO3 + O2↑ + 2H2O |
Термическая устойчивость пероксидов, надпероксидов и озонидов щелочных металлов увеличивается с увеличением радиуса катиона (так как соблюдается принцип структурного соответствия).
Принцип структурного соответствия:
ü наиболее прочную кристаллическую решетку образуют близкие по размерам катионы и анионы, т.е. маленькие катионы с маленькими анионами, либо крупные катионы с крупными анионами.
Прочная кристаллическая решетка определяет:
ü большую термическую устойчивость;
ü меньшую растворимость в воде
r(Li+) < r(Na+) < r(K+)
r(O2-) < r(O22-) < r(O2-)
Именно поэтому при сгорании щелочных металлов на воздухе наиболее устойчивыми соединениями являются: Li2O, Na2O2, KO2.
Вопрос 3. Опишите способы получения оксидов и пероксидов элементов IIА-группы в лаборатории.
| Кислородные соединения | Получение |
| MO (оксиды) | 1. Сжигание металлов в токе кислорода: 2M(тв.) + O2 = 2MO(тв.) 2. Термическое разложение карбонатов металлов: CaCO3 = CaO + CO2 |
| MO2 (пероксиды) | 1. Взаимодействие оксидов или гидроксидов металлов с пероксидом водорода на холоду: M(OH)2 + H2O2 = MO2 + 2H2O 2. Сжигание металлов в кислороде при высоком его давлении: M + O2 = MO2 |
Вопрос 4. Бинарные соединения: получение нитрида магния в лаборатории
При сгорании магния на воздухе протекают два независимых процесса, которым соответствуют два уравнения:
2Mg + O2 = 2MgO
3Mg + N2 = Mg3N2
Образовавшийся спёк белого цвета состоит из нитрида и оксида магния. Возможно присутствие также непрореагировавшего металлического магния.
При взаимодействии спёка с водой протекает реакция необратимого гидролиза нитрида магния. Образовавшийся раствор имеет щелочную среду, которая обусловлена следующими равновесиями: протолизом гидрата аммиака и фазовым равновесием, которое устанавливается в насыщенном растворе образовавшегося гидроксида магния:
Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3∙H2O
Mg(OH)2(тв.) ↔ Mg2+ + 2OH-
NH3∙H2O + H2O ↔ NH4+ + OH- + H2O
При обработке полученного спёка кислотами в раствор переходит как нитрид, так и оксид магния:
MgO + 2H3O+ = Mg2+ + 3H2O
Mg3N2 + 8H3O+ = 3Mg2+ + 2NH4+ + 8H2O
С водными растворами щелочей оксид магния не вступает в химическую реакцию, а нитрид магния подвергается необратимому гидролизу.
Гидроксид щелочного металла не участвует в реакции, но влияет на растворимость аммиака. Растворимость аммиака в щелочных растворах согласно закону Сеченова уменьшается (происходит «эффект высаливания»). Поэтому при обработке спёка водным раствором щелочи наблюдается выделение газообразного продукта. Выделению аммиака способствует и нагревание реакционной смеси.
Вопрос 5. Опишите способы получения гидроксидов s-элементов в лаборатории. Как меняется их термическая устойчивость и растворимость при движении вниз по группам. Дайте обоснованный ответ.
|
Гидроксид | Получение | |
| В промышленности | В лаборатории | |
| MOH | 1. Электролиз растворов хлоридов с инертным анодом и диафрагмой: 2MCl(раствор) + 2H2O = 2MOH + H2↑ + Cl2↑ Примечание: Для получения гидроксида натрия используют ртутный анод. При этом атомы натрия связываются в амальгаму, которую затем разрушают водой, выделяя гидроксид натрия. Для обезвоживания щелочь расплавляют и гранулируют. | 1. Длительное кипячение карбонатов щелочных металлов с гидроксидом кальция (искл. Li): M2CO3 + Ca(OH)2 = CaCO3 + 2MOH |
| Be(OH)2 | 1. Взаимодействие хорошо растворимых солей бериллия с концентрированным раствором гидрата аммиака: Be2+ +2(NH3∙H2O) = Be(OH)2 + 2NH4+ 2. Пропускание через раствор [Be(OH)4]2- углекислого газа: [Be(OH)4]2- + 2CO2 = Be(OH)2 + 2HCO3- Проводить осаждение гидроксида бериллия водными растворами щелочей нельзя, так как образуется устойчивый гидроксокомплекс бериллия: Be(OH)2 + 2OH- =[Be(OH)4]2- | |
| Mg(OH)2 | 1. Взаимодействие хорошо растворимых солей магния с концентрированным раствором гидрата аммиака и с растворами щелочей: Mg2+ +2(NH3∙H2O) = Mg(OH)2 + 2NH4+ Mg2+ + 2OH- = Mg(OH)2 | |
| Ca(OH)2 – Ra(OH)2 | 1. Взаимодействие соответствующих оксидов с водой: MO + H2O = M(OH)2 | |
Термическая устойчивость и растворимость в воде гидроксидов IА-группы возрастает от LiOH к CsOH. Для элементов IIА-группы термическая устойчивость и растворимость изменяются аналогичным образом. В это проявляется аналогия с гидроксидами щелочных элементов.
Вопрос 6. Почему гидроксид магния в отличие от гидроксида бериллия растворяется в концентрированном растворе хлорида аммония? Опишите химизм процесса. Рассчитайте константу равновесия данного процесса.
Mg(OH)2 + 2NH4+ ↔ Mg2+ + 2(NH3∙H2O)
Kc = 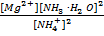
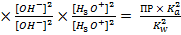 =
= 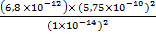 = 0,02
= 0,02
Mg(OH)2(тв.) ↔ Mg2+ + 2OH-
ПР = [Mg2+][OH-]2 = 6,8∙10-12
NH4Cl = NH4+ + Cl-
NH4+ + 2H2O ↔ NH3∙H2O + H3O+; Ka = 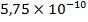
Рассчитанное значение константы равновесия указывает на то, что растворение гидроксида магния возможно в избытке концентрированного раствора хлорида аммония.
Вопрос 7. Опишите, почему происходит окрашивание пламени спиртовки при внесении в ее пламя солей щелочных и щелочноземельных металлов?
Атомы, находящиеся в состоянии одноатомного пара, при тепловом воздействии переходят в возбужденное состояние: валентный электрон с s-подуровня переходит на p-подуровень. Такое состояние крайне неустойчиво, и атом возвращается в основное состояние, испуская квант света определенной длины волны. Если его энергия оказывается в видимой части спектра и имеет высокую интенсивность, этот переход приводит к появлению окраски.
Li – карминово-красный цвет; Na – желтый цвет; K – фиолетовый цвет; Rb – розово-фиолетовый цвет; Ca – кирпично-красный цвет; Sr – карминово-красный цвет; Ba – желто-зеленый цвет.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|