
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ответы к задачам. KCl → K → KO3 → KAl(SO4)2∙12H2O. Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
Ответы к задачам
Задача 1. Осуществите следующие превращения (укажите условия проведения реакций; число стадий должно быть минимальное):
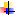 KCl → K → KO3 → KAl(SO4)2∙12H2O → K2S
KCl → K → KO3 → KAl(SO4)2∙12H2O → K2S
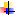 Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
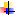 LiOH → LiCl → Li2CO3 → Li2O → X → Li → LiNH2
LiOH → LiCl → Li2CO3 → Li2O → X → Li → LiNH2
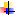 Na2SO4 → Na2CO3 → NaOH → NaClO3 → NaCl → NaHCO3 → Na2CO3
Na2SO4 → Na2CO3 → NaOH → NaClO3 → NaCl → NaHCO3 → Na2CO3
KCl → K → KO3 → KAl(SO4)2∙12H2O
1. 2KCl(расплав) 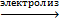 2K + Cl2
2K + Cl2
2. K + O2  KO2
KO2
KO2 + O3 = KO3 + O2
3. 2KO3 + 2SO2 = K2SO4 + 3O2
4. K2SO4 + Al2(SO4)3 + 12H2O 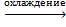 2KAl(SO4)2·12H2O↓
2KAl(SO4)2·12H2O↓
Реакцию (4) проводят при охлаждении раствора, поскольку водные растворы солей алюминия сильно гидролизованы, а так как гидролиз – эндотермический процесс, то при нагревании равновесие протолиза аквакатиона алюминия сильно смещено в сторону образования катиона гидроксопентаакваалюминия. Так как в растворе присуствуют сульфат – ионы, то они начинают встраиваться во внутренную сферу образовавшихся гидроксокомплексов алюминия, и в конечном итоге, это приводит к образованию малорастворимых основных солей. Поэтому получение алюмокалиевых квасцов проводят исключительно из охлажденного раствора, поскольку в этих условиях гидролиз сульфата алюминия значительно подавлен.
Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
1. 2Na + O2  Na2O2
Na2O2
2Na2O2 + 2H2SO4(конц., хол.) = 2Na2SO4 + 2H2O + O2
2. Na2SO4(тв.) + 4C(тв.) 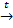 Na2S + 4CO
Na2S + 4CO
3. Na2S(тв.) + CaCO3(тв.) 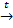 Na2CO3 + CaS
Na2CO3 + CaS
4. Na2CO3 + Ca(OH)2(насыщ.р.) 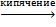 CaCO3↓ + 2NaOH
CaCO3↓ + 2NaOH
LiOH → LiCl → Li2CO3 → Li2O → X → Li → LiNH2
1. 2LiOH 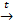 Li2O + H2O
Li2O + H2O
Li2O + 2HCl = 2LiCl + H2O
2. 2LiCl + Na2CO3(конц.) 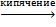 Li2CO3 + 2NaCl
Li2CO3 + 2NaCl
3. Li2CO3 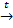 Li2O + CO2
Li2O + CO2
4. Li2O + 2HCl = 2LiCl + H2O
5. 2LiCl(расплав) 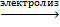 2Li + Cl2
2Li + Cl2
6. 2Li(тв.) + 2NH3(г.) = 2LiNH2 + H2
Na2SO4 → Na2CO3 → NaOH → NaClO3 → NaCl → NaHCO3 → Na2CO3
1. Na2SO4(тв.) + CaCO3(тв.) 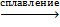 Na2CO3 + CaSO4
Na2CO3 + CaSO4
2. Na2CO3 + Ca(OH)2(насыщ.р.) 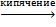 2NaOH + CaCO3
2NaOH + CaCO3
3. 6Cl2 + 12NaOH(конц., гор.) 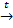 10NaCl + 2NaClO3 + 6H2O
10NaCl + 2NaClO3 + 6H2O
4. 2NaClO3(тв.)  2NaCl + 3O2
2NaCl + 3O2
5. NaCl + H2O + CO2 + NH3 = NaHCO3↓ + NH4Cl – метод Сольве
6. 2NaHCO3(тв.) 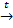 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Примечание к реакции (5). В настоящее время соду производят по методу Сольве. Метод Сольве основан на низкой растворимости гидрокарбоната натрия в концентрированных солевых растворах. В водно-аммиачный насыщенный хлоридом натрия раствор пропускают углекислый газ, при этом образующийся NaHCO3, как менее растворимый в этих условиях выпадает в осадок.
Метод Сольве нельзя использовать для получения KHCO3 из-за его значительно большей растворимости.
Задача 2. Осуществите следующие превращения (укажите условия проведения реакций; число стадий должно быть минимальное):
Be(NO3)2 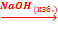 X1
X1 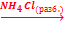 X2
X2 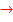 BeCl2
BeCl2
1. Be(NO3)2 + 4NaOH = Na2[Be(OH)4] + 2NaNO3
2. Na2[Be(OH)4] + 2NH4Cl = Be(OH)2 + 2NH3·H2O + 2NaCl
3. Be(OH)2 + 2HCl = BeCl2 + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|