
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ответы на Химию с openedu
Ответы на Химию с openedu
Аванпост ЛаПлаза № 3X^3+const
Тест 1.
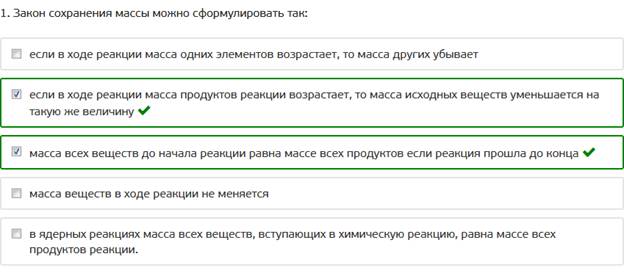
1. Закон сохранения массы можно сформулировать так:
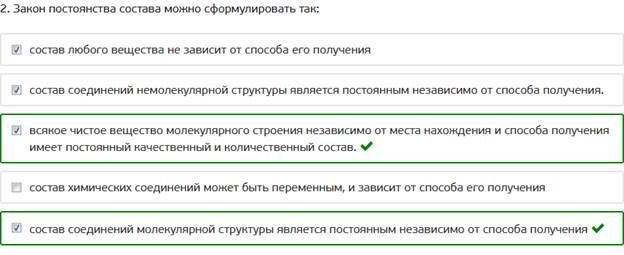
2. Закон постоянства состава можно сформулировать так:
3. К классу простых веществ относятся вещества:

4. Реакция относится к следующему типу:

5. Реакцию можно охарактеризовать как:

6. Реакцию относят к реакциям:

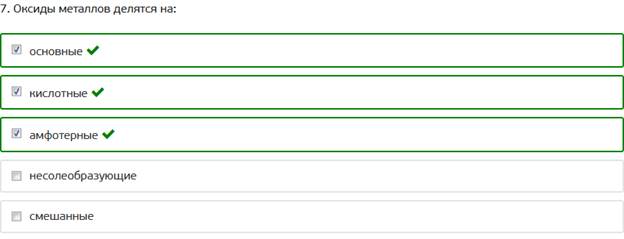
7. Оксиды металлов делятся на:
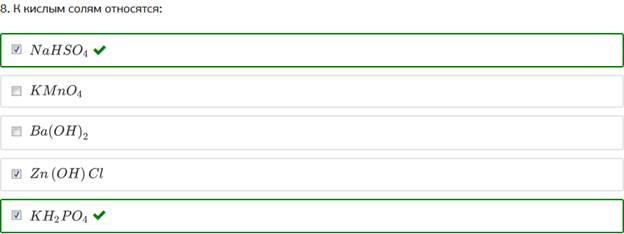
8. К кислым солям относятся:
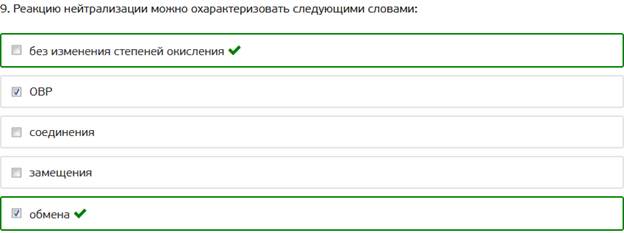
9. Реакцию нейтрализации можно охарактеризовать следующими словами:
10. Окислительно-восстановительными являются реакции …:

Тест 2.
1. Главное квантовое число (n) для элементов 3 периода принимает значения:

2. Спиновое квантовое число (s) для электронов в атоме принимает значения:

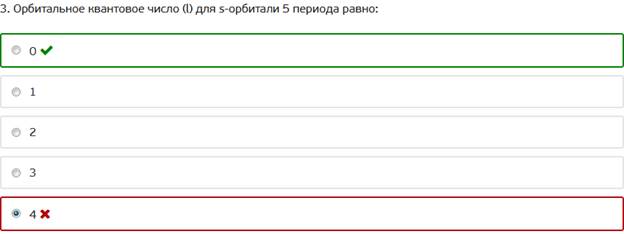
3. Орбитальное квантовое число (l) для s-орбитали 5 периода равно:
4. Магнитное квантовое число (m) для d-элементов 5 периода принимает значения:

5. Согласно правилу Хунда, в пределах энергетического подуровня заполнение орбиталей электронами происходит так, чтобы значение суммарного спина было:

6. Согласно правилу Клечковского, заполнение энергетических подуровней электронами происходит в порядке возрастания:

7. Энергия электрона в многоэлектронном атоме определяется следующими квантовыми числами:

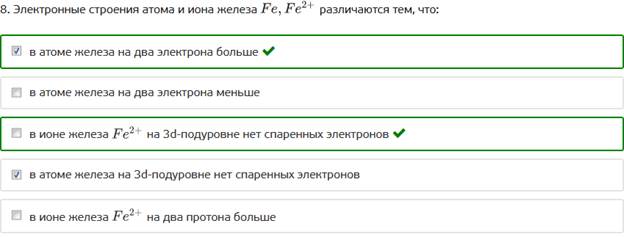
8. Электронные строения атома и иона железа различаются тем, что:
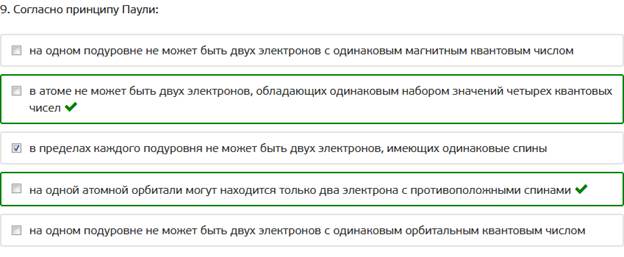
9. Согласно принципу Паули:
10. – это электронная формула:
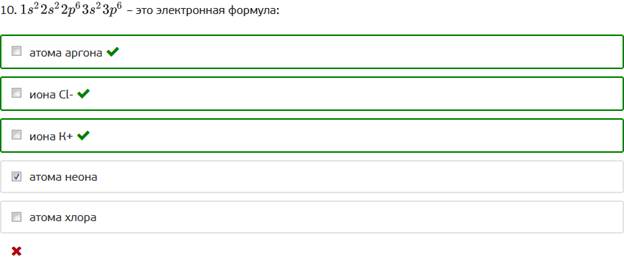
Тест 3.
1. Количество протонов в атоме любого элемента таблицы Д.И. Менделеева совпадает с...

2. Количество электронов в атоме любого элемента таблицы Д.И. Менделеева совпадает с...

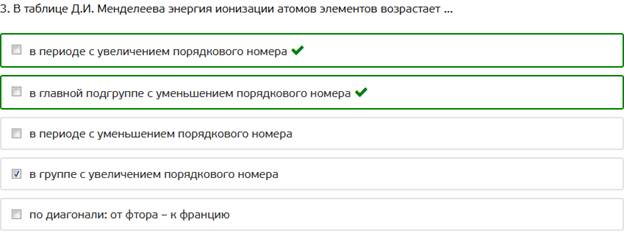
3. В таблице Д.И. Менделеева энергия ионизации атомов элементов возрастает ...
4. В таблице Д.И. Менделеева относительная электроотрицательность атомов элементов возрастает:

5. Важнейшие периодические свойства химических элементов:

6. Максимальное число электронов на третьем энергетическом уровне:

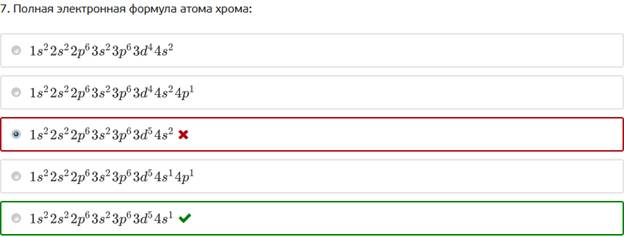
7. Полная электронная формула атома хрома:
8. – это полная электронная формула:

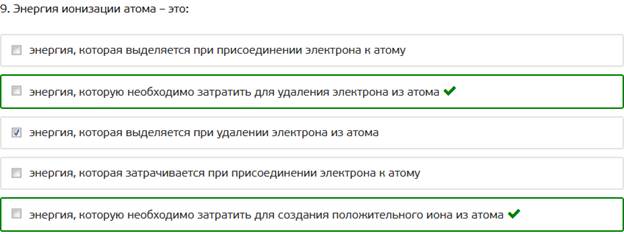
9. Энергия ионизации атома – это:
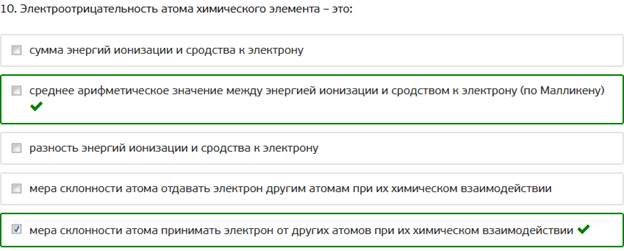
10. Электроотрицательность атома химического элемента – это:
Тест 4.
1. Химическая связь образуется в результате:

2. К основным видам химической связи относятся:

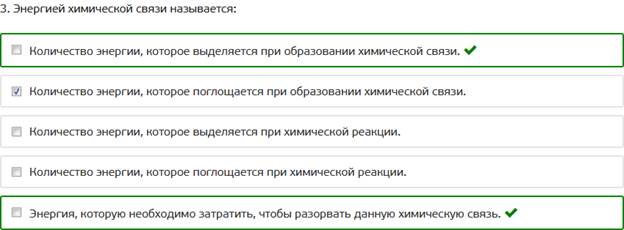
3. Энергией химической связи называется:
4. Ионная химическая связь между различными атомами образуется в результате:

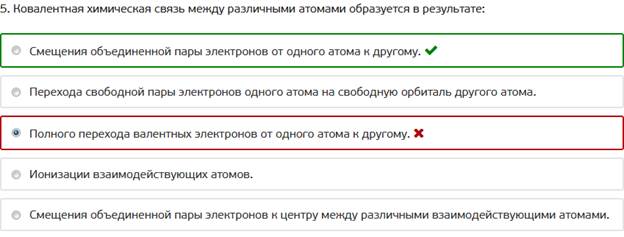
5. Ковалентная химическая связь между различными атомами образуется в результате:
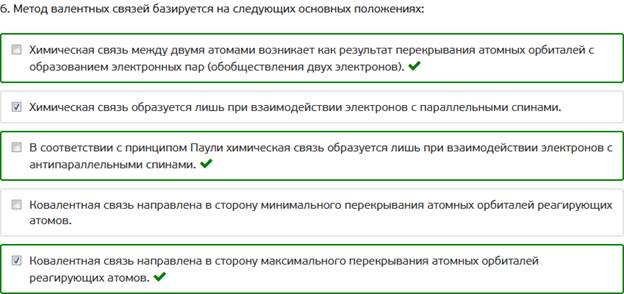
6. Метод валентных связей базируется на следующих основных положениях:
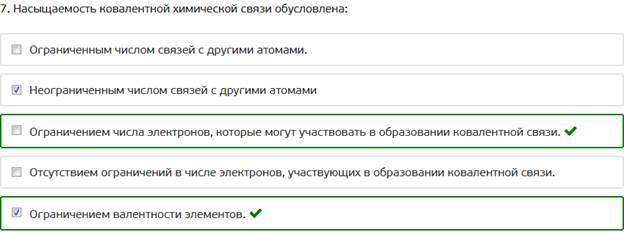
7. Насыщаемость ковалентной химической связи обусловлена:
8. Направленность ковалентной химической связи обусловлена:

9. При гибридизации одной s- орбитали и трех p-орбиталей атома возникают:

10. Донорно-акцепторная химическая связь между различными атомами образуется в результате:

11. Образование межмолекулярных водородных связей приводит к:

Тест 5.
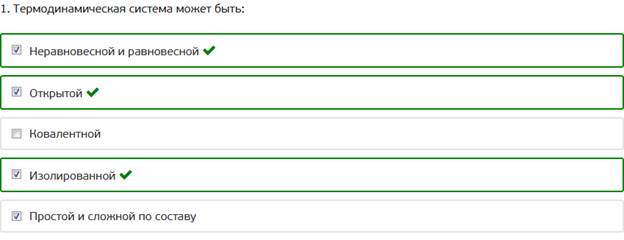
1. Термодинамическая система может быть:
2. Под внутренней энергией системы U понимают общий запас ее энергии, за вычетом:

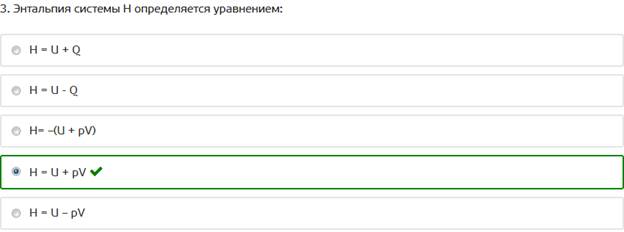
3. Энтальпия системы H определяется уравнением:
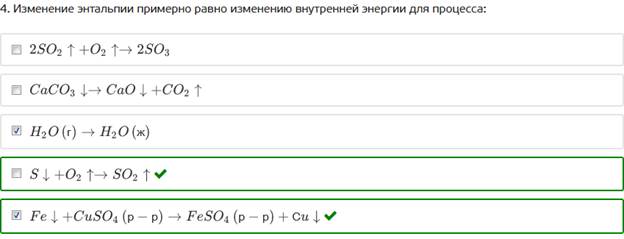
4. Изменение энтальпии примерно равно изменению внутренней энергии для процесса:
5. Изменение энтальпии примерно равно изменению внутренней энергии для процесса:

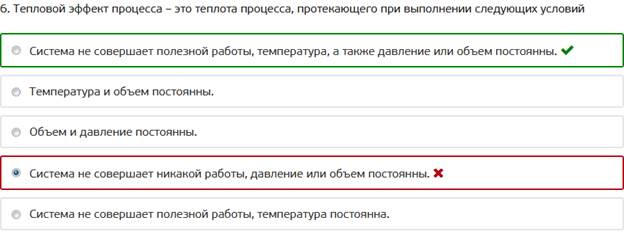
6. Тепловой эффект процесса – это теплота процесса, протекающего при выполнении следующих условий
7. Согласно закону Гесса для химической реакции СграфитОСО тепловой эффект не изменится:

8. Тепловой эффект реакции (∆H)

9. Тепловой эффект реакции (∆H)

10. Тепловой эффект реакции (∆H)

Тест 6.
1. Стандартный тепловой эффект образования Al2(SO4)3 равен стандартному тепловому эффекту реакции

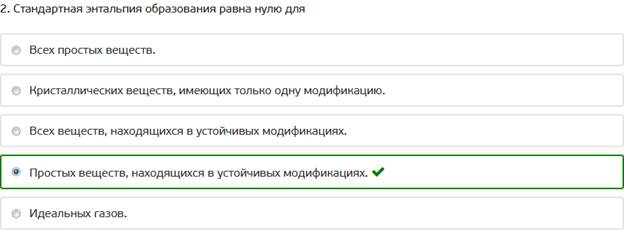
2. Стандартная энтальпия образования равна нулю для
3. Вещества расположены в порядке возрастания энтропии в ряду:

4. Энтропия заметно увеличивается в реакции:

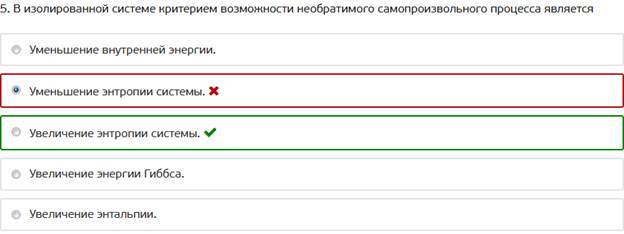
5. В изолированной системе критерием возможности необратимого самопроизвольного процесса является
6. Через энтальпию и энтропию в термодинамике вводится энергия Гиббса, которая по определению есть:

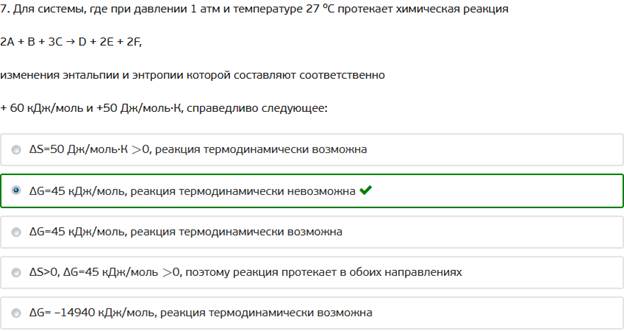
7. Для системы, где при давлении 1 атм и температуре 27 ⁰С протекает химическая реакция
2А + В + 3С → D + 2E + 2F,
изменения энтальпии и энтропии которой составляют соответственно
+ 60 кДж/моль и +50 Дж/моль·К, справедливо следующее:
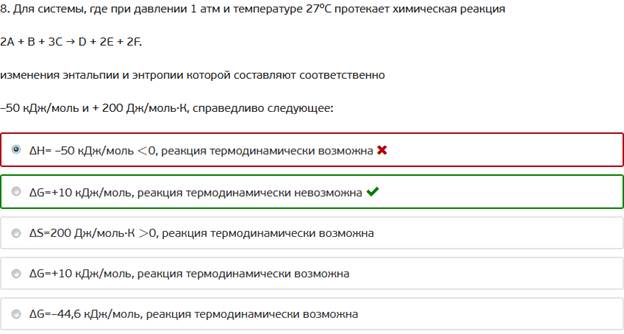
8. Для системы, где при давлении 1 атм и температуре 27⁰С протекает химическая реакция
2А + В + 3С → D + 2E + 2F.
изменения энтальпии и энтропии которой составляют соответственно
–50 кДж/моль и + 200 Дж/моль·К, справедливо следующее:
9. Не проводя расчетов, укажите, какие реакции с термодинамической точки зрения возможны при стандартных условиях в изобарно-изотермических системах):

10. Абсолютные значения определены для следующих термодинамических функций

Тест 7.
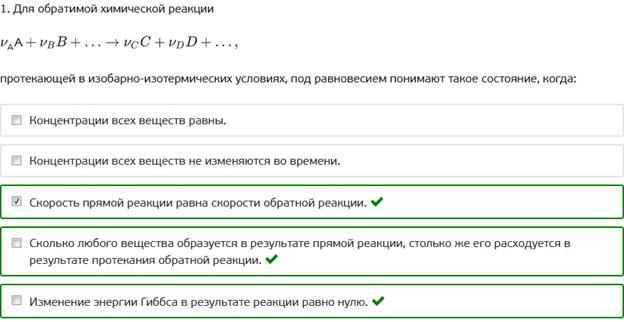
1. Для обратимой химической реакции
2. При равновесии концентрации всех веществ, участвующих в реакции, связаны между собой. Поэтому:

3. Для обратимой химической реакции

4. Какие уравнения описывают состояние химического равновесия для реакции

5. Для обратимой химической реакции

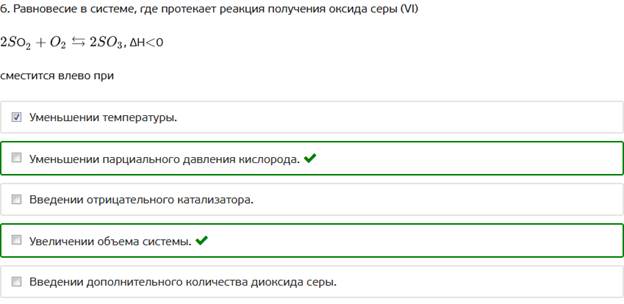
6. Равновесие в системе, где протекает реакция получения оксида серы (VI)
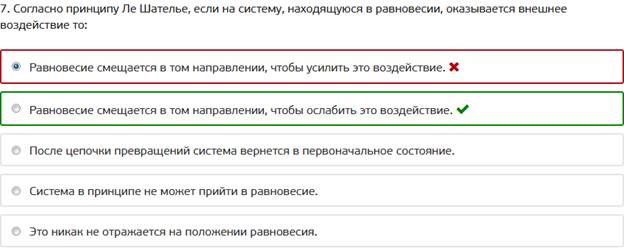
7. Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказывается внешнее воздействие то:
8. Равновесие в системе, где протекает реакция разложения
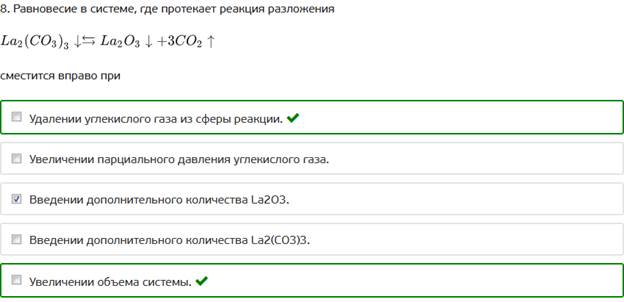
9. Если в системе протекает обратимая химическая реакция с участием газообразных веществ

10. Если в системе протекает обратимая химическая реакция

Тест 8.
1. Равновесие в системе, где протекает реакция гидролиза

2. Равновесие в системе, где протекает реакция гидролиза

3. Равновесие в системе, где протекает реакция гидролиза

4. Равновесие реакции диссоциации СН3СООН

5. Равновесие реакции диссоциации

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|