
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задания олимпиады по химии. Задача 1. (5 баллов). Задача 2. (10 баллов). Задача 3.(10 баллов). установилось при следующих концентрациях: [COCl2] = 3 моль/л; [CO] = 6 моль/л. Вычислить константу химического равновесия для данной реакции и исходную концентр
Задания олимпиады по химии
Задача 1. (5 баллов)
Оксид железа (III) растворили в избытке раствора соляной кислоты. Раствор разделили на две части. К одной части добавили избыток железа, при этом наблюдали выделение газа и исчезновение желтого окраски раствора. Ко второй части добавили йодид калия и наблюдали усиление желтой окраски. Напишите уравнения реакций и укажите окислитель и восстановитель в окислительно-восстановительной реакции.
Задача 2. (10 баллов)
Предложите наиболее короткий способ получения дихромата аммония из нитрата хрома(III). В лаборатории имеется серная кислота, едкий натр, алюминий, баритовая вода, цинк, перекись водорода, хлорид калия, вода и другие реактивы. Нельзя использовать реагенты, содержащие в своем составе хром или азот.
Задача 3.(10 баллов)
Известно, что многие реакции являются обратимыми и в определенный момент наступает равновесие.
При нагревании СОС12 в закрытом сосуде до некоторой температуры равновесие реакции: COCl2 ⇄CO + Cl2
установилось при следующих концентрациях: [COCl2] = 3 моль/л; [CO] = 6 моль/л. Вычислить константу химического равновесия для данной реакции и исходную концентрацию СОСl2.
1) Вычислите константу равновесия системы и исходную концентрацию СОСl2
2) Рассчитайте давление в сосуде объемом 20 л, где содержится указанная равновесная смесь газов, при температуре 50 оС.
3) Назовите тривиальное название вещества COCl2? Чем известно это вещество?
4) Какими станут равновесные концентрации веществ, если увеличить объем в три раза
Задача 4. (10 баллов)
Хлор получают в лабораторных условиях взаимодействием оксида марганца (IV) с концентрированным раствором соляной кислоты. Сколько граммов оксида Mn (IV) и миллилитров 36,4 %-ного раствора соляной кислоты (пл. 1,19 г/мл) нужно взять для получения хлора в количестве, необходимом для полного сгорания 44,8 г тонкой раскаленной проволоки из неизвестного металла? Если через раствор соли двухвалентного металла, образовавшейся в результате сгорания, пропустить ток сероводорода, то выпадает 57,6 г желтого осадка. Из какого металла сделана проволока? Напишите уравнения, протекающих реакций.
Задача 5. (15 баллов)
Напишите уравнения реакций и укажите условия получения из пропина соединений Х1-Х10 с использованием неорганических веществ и веществ, полученных на предыдущих стадиях. Назовите вещества Х1-Х10.
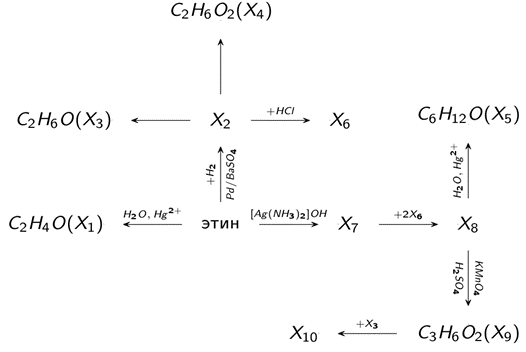
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|