
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Промежуточная аттестация по курсу 11 класса (УМК Габриеляна – базовый уровень)
Промежуточная аттестация по курсу 11 класса (УМК Габриеляна – базовый уровень)
Проверяемые элементы содержания.
Часть 1 содержит 8 заданий с кратким ответом (базовый уровень сложности).
А1 – Строение атомов химических элементов Периодической системы Д. И. Менделеева
А2 – Типы химической связи
А3 – Типы кристаллических решеток
А4 – Классификация неорганических соединений
А5 – Скорость химических реакций
А6 – Способы смещения химического равновесия
А7 – Расчет массовой доли растворенного вещества в растворе
А8 - Расчет по термохимическому уравнению
Часть 2 содержит 4 задания с кратким ответом (повышенный уровень сложности)
В1 – Классификация органических соединений
В2 – Химические свойства простых и сложных неорганических веществ
В3 – Гидролиз солей
В4 – Электролиз растворов солей
Часть 3 содержит два задания с развернутым ответом (высокий уровень сложности).
С1 – Взаимосвязь различных классов неорганических веществ, осуществление предложенных превращений
С2 – Окислительно- восстановительные реакции, их уравнивание методом электронного баланса
Оценивание работы.
За правильный ответ в части А – 1 балл
За полный правильный ответ в части В – 2 балла; если допущена одна ошибка – 1 балл;
за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За полный правильный ответ в части С:
С1 – 5 баллов
С2 – 3 балла
Итого максимально 24 балла.
Критерии оценивания С1:
по 1 баллу за каждое уравнение реакции (всего 5 баллов)
Критерии оценивания С2:
Определены степени окисления и составлен баланс – 1 балл;
Выставлены коэффициенты в исходное уравнение – 1 балл;
Определены окислитель и восстановитель – 1 балл (всего 3 балла)
Шкала пересчета первичных баллов в отметку
| Общий балл | 0 - 7 | 8 - 14 | 15 - 19 | 20 -24 |
| Отметка |
*Для получения отметки «4» необходимо получить не менее 3 баллов в части С.
*Для получения отметки «5» необходимо получить не менее 5 баллов в части С.
Вариант 1.
1.B ряду химических элементов
Si® Al ® Mg ®Na
| 1) | увеличивается число валентных электронов в атомах |
| 2) | уменьшается число электронных слоев в атомах |
| 3) | уменьшается число протонов в ядрах атомов |
| 4) | увеличиваются радиусы атомов |
2.Вещество с ковалентной полярной связью имеет формулу
| 1) | KCl | 2) | HBr | 3) | Р4 | 4) | CaCl2 |
3.К веществам с атомной кристаллической решеткой относятся
| 1) | натрий, фтор, оксид серы (IV) | ||||||||
| 2) | свинец, азотная кислота, оксид магния | ||||||||
| 3) | бор, алмаз, карбид кремния | ||||||||
| 4) | хлорид калия, белый фосфор, иод
4.Верны ли следующие суждения о свойствах оксида хрома (III)? А. Оксид хрома (III) проявляет амфотерные свойства. Б. Оксид хрома (III) проявляет только восстановительные свойства.
|
5.С образованием щелочи с водой взаимодействует
| 1) | алюминий | 2) | цинк | 3) | барий | 4) | ртуть |
6.Гидроксид кальция не взаимодействует с
| 1) | HCl | 2) | CO2 | 3) | ZnS | 4) | HNO3 |
7. В схеме превращений
NO 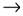 X
X 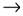 NaNO3
NaNO3
веществом «X» является
| 1) | N2 |
| 2) | NН3 |
| 3) | КNO3 |
| 4) | NO2 |
8.К фенолам относится вещество, формула которого
| 1) | C6H5 – O – CH3 |
| 2) | C6H13 – OH |
| 3) | C6H5 – OH |
| 4) | C6H5 – CH3 |
9.Уксусная кислота может реагировать с
| 1) | карбонатом калия |
| 2) | муравьиной кислотой |
| 3) | серебром |
| 4) | оксидом серы (IV) |
10. К реакциям обмена и соединения относятся соответственно
| 1) | C6H5OH + NaOH 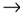 C6H5ONa + H2O и 2Cu + O2 = 2CuO C6H5ONa + H2O и 2Cu + O2 = 2CuO
|
| 2) | CH4 + Cl2 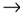 CH3Cl + HCl и 2H2 + O2 = 2H2O CH3Cl + HCl и 2H2 + O2 = 2H2O
|
| 3) | 2SO2 + O2 → 2SO3 и K2SO3 + 2HCl = 2KCl + SO2↑ + H2O |
| 4) | NH4OH → NH3 + H2O и 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu |
11.Формула соединения углерода, проявляющего токсичные свойства,
| 1) | NaHCO3 | 2) | Na2CO3 | 3) | CaCO3 | 4) | CO |
12.Реакции полимеризации этилена соответствует схема
| 1) | nCH2 = CH2 (– CH®2 – CH2 – )n |
| 2) | + CH×R2 R – CH®= CHCl 2 ×– CH ÷ Cl |
| 3) | + CH×2R2 = CH2 R – CH®2 – CH2 – R |
| 4) | CH2 = CH2 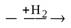 CH3 – CH3 CH3 – CH3
|
13.Кислую среду имеет водный раствор
| 1) | Na3PO4 |
| 2) | KCl |
| 3) | Na2CO3 |
| 4) | ZnSO4 |
14.Сокращенное ионное уравнение
Ca2+ + CO32– CaCO®3
соответствует взаимодействию
| 1) | хлорида кальция и карбоната натрия |
| 2) | сульфида кальция и углекислого газа |
| 3) | гидроксида кальция и углекислого газа |
| 4) | фосфата кальция и карбоната калия |
15. В соответствии с термохимическим уравнением
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2816кДж
выделится 1408 кДж теплоты, если в реакции участвует кислород количеством вещества
| 1) | 1,5 моль | 2) | 3 моль | 3) | 4,5 моль | 4) | 6 моль |
Вариант 2.
1.В каком ряду простые вещества расположены в порядке усиления металлических свойств?
| 1) | Mg, Ca, Ba |
| 2) | Na, Mg, Al |
| 3) | K, Ca, Fe |
| 4) | Sc, Ca, Mg |
2.В соединениях:
PH3, P2O5, H3PO3
фосфор имеет степени окисления, соответственно равные
| 1) | + 3; + 5; – 3 |
| 2) | – 3; + 5; + 3 |
| 3) | – 3; + 3; + 5 |
| 4) | + 3; – 5; – 3 |
3.Только кислоты расположены в ряду
| 1) | HNO3, Ca(NO3)2, NO2 |
| 2) | KHCO3, Ba(HSO4)2, Zn(OH)Cl |
| 3) | HNO2, HNO3, CH3COOH |
| 4) | H2S, Na2SO3, SO2 |
4.Сера является окислителем в реакции с
| 1) | кислородом |
| 2) | металлами |
| 3) | хлором и фтором |
| 4) | азотной кислотой |
5.Оксид серы (IV) взаимодействует с каждым из двух веществ:
| 1) | H2O и KCl |
| 2) | Ba(OH)2 и CaO |
| 3) | CaCO3 и ZnSO3 |
| 4) | Ca(OH)2 и N2 |
7. Органическое вещество, молекулярная формула которого С7Н8, относится к гомологическому ряду
| 1) | метана | 2) | этилена | 3) | бензола | 4) | ацетилена |
8.При обычных условиях с наименьшей скоростью протекает реакция между
| 1) | Fe и O2 |
| 2) | CaCO3 и HCl(р-р) |
| 3) | Na и O2 |
| 4) | Na2SO4(р-р) и BaCl2(р-р) |
9.В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
| 1) | 2SO2(г) + O2(г) →2SО3(г) + Q |
| 2) | N2(г) + О2(г) →2NO(г) – Q |
| 3) | CO2(г) + 2C(тв.) →2CO(г) – Q |
| 4) | 2NH3(г) →N2(г) + 3H2(г) – Q |
10. В качестве катионов только ионы Н+ образуются при диссоциации
| 1) | NaOH | 2) | NaH2PO4 | 3) | H2SO4 | 4) | NaHSO4 |
11.Раствор сульфата меди (II) реагирует с каждым из двух веществ:
| 1) | HCl и H2SiO3 |
| 2) | H2O и Cu(OH)2 |
| 3) | О2 и HNO3 |
| 4) | NaOH и BaCl2 |
12.Бензол вступает в реакцию замещения с
| 1) | бромом и азотной кислотой |
| 2) | кислородом и серной кислотой |
| 3) | хлором и водородом |
| 4) | азотной кислотой и водородом |
13.В молекулах какого вещества отсутствуют p-связи?
| 1) | этина | 2) | изобутана | 3) | этена | 4) | циклопентена |
14.Восстановительные свойства железо проявляет в реакции:
| 1) | FeO + H2SO4 = FeSO4 + H2O |
| 2) | Fe(OH)2 + 2HCl = FeCl2 + 2H2O |
| 3) | 2FeCl2 + Cl2 = 2FeCl3 |
| 4) | FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl |
15.Какой объём (н.у.) оксида азота (ΙΙ) теоретически образуется при каталитическом окислении 500 л. (н.у.) аммиака?
1). 250 л.
2).500 л.
3).875 л.
4).125 л.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|