
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Обратимость химических реакций.
Тема: Обратимость химических реакций.
Цели урока:
Формирование понятий о химическом равновесии и способах его смещения;
Формирование представлений о константе химического равновесия, умений записывать выражения константы равновесия для гомогенных и гетерогенных реакций;
Выявление единства и взаимосвязи химических превращений в реакциях между неорганическими и органическими веществами, их познаваемость, возможность управления химическими реакциями.
Тип урока: урок открытия новых знаний
 Ход урока
Ход урока
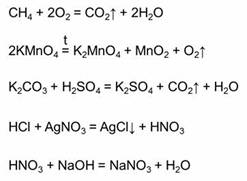
Все химические реакции делятся на обратимые и необратимые.
Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций термического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
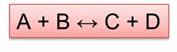
Реакция образования веществ С и D является прямой, а реакция образования А и В является обратной.

Обратимыми являются также реакции этерификации – это реакции взаимодействия карбоновых кислот со спиртами.
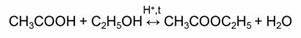
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.

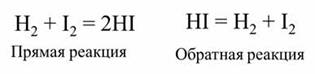 Обратимой является реакции синтеза йодоводорода из водорода и йода.
Обратимой является реакции синтеза йодоводорода из водорода и йода.
 После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|