
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Нахождение аминов в природе
Тема. Классификация и изомерия аминов.
Тип занятия изучения новых знаний
Форма проведения: комбинированныйурок
Цели занятия.
Учебная: рассмотреть строение и классификацию аминов; проиллюстрировать положение теории строения органических соединений о взаимном влиянии атомов в молекулах на примере анилина
Развивающие: развивать умения для поиска взаимосвязи между новым и изученным материалом, устанавливать причинно-следственные связи между явлениями, формирование умений абстрактно мыслить, анализировать, ставить проблемы и находить пути их решения.
Воспитательные: Формирование навыков работы в коллективе ученик – ученик, ученик – учитель. Уметь анализировать полученную информацию.
После изучения темы студент должен знать:
- общую формулу аминов, их классификацию
· характерные особенности электронного и пространственного строения аминов
· номенклатуру (систематические и тривиальные названия),
· виды изомерии
· физические свойства
· Амины– азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
2. Функциональная группа: - NH2 аминогруппа 3. Классификация аминов:
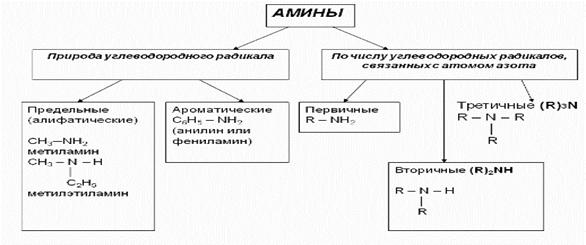
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
Обычно выделяют три типа аминов:
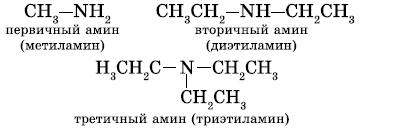
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную аминогруппу (NH2—).
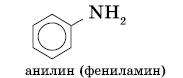
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
4. Нахождение аминов в природе
Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный яд”, встречающиеся в художественной литературе, связано с аминами.
5. Номенклатура аминов 1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин 
При наличии одинаковых радикалов используют приставки ди и три. (CH3)2NH
Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
6. Изомерия аминов Структурная изомерия - углеродного скелета, начиная с С4H9NH2:


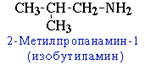
- положения аминогруппы, начиная с С3H7NH2:
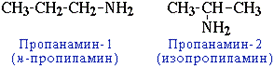
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
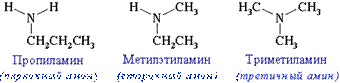
Пространственная изомерия Возможна оптическая изомерия, начиная с С4H9NH2
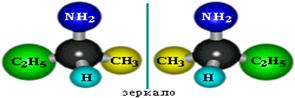
Физические свойства аминов
Простейшие амины (метиламин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 °С.
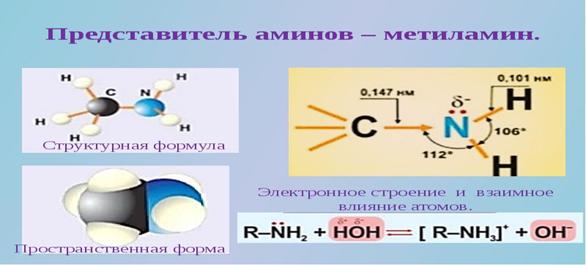
6. Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований. По месту неподелённой электронной пары у атома азота амины способны присоединять катион водорода (из молекул воды и молекул кисло, повторим как это происходит у аммиака) 
как аммиак и проявлять свойства бескислородных оснований
Решите задачу: Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина. Составьте возможные изомеры разных типов и дайте им названия .
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|