
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опорный конспект по теме. Химические свойства щелочных металлов». Химические свойства щелочных металлов
Опорный конспект по теме
«Химические свойства щелочных металлов»
1. Повторение материала темы: «Строение атомов щелочных металлов»:
Щелочные металлы являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне один электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильнейшими восстановителями). Понятно, что в соответствии с ростом радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию.
Выводы:
1) На внешнем энергетическом уровне атомы этих элементов содержат по одному валентному электрону. Следовательно во всех своих соединениях атомы могут иметь только степень окисления +1. Атомы щелочных металлов всегда одновалентны.Степень окисления простых веществ всегда равна 0.
2) В подгруппе от лития к цезию радиусы атомов увеличиваются, так как возрастает число электронных слоев, следовательно, усиливаются и восстановительные свойства, и степень выраженности металлических свойств.
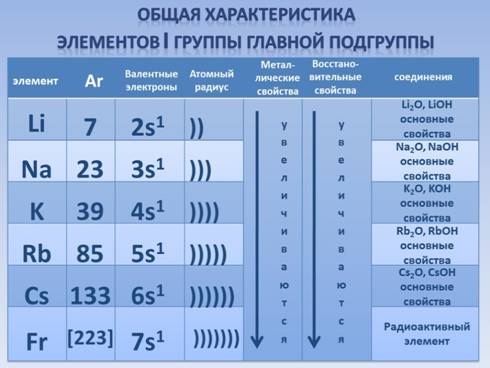
2. Химические свойства щелочных металлов
Так как щелочные металлы по степени выраженности металлических свойств - это самые яркие представители среди металлов, то они обладают всеми общими химическими свойствами, характерными для металлов. Щелочные металлы быстро окисляются на воздухе, поэтому их хранят под слоем керосина, а литий в вазелине, так как из-за своей легкости он в керосине всплывает. Щелочные металлы активно взаимодействуют почти со всеми неметаллами (хлором, водородом, серой, кислородом). При взаимодействии с кислородом лития образуется оксид, а натрий и калий в данном случае образуют пероксиды. Все щелочные металлы активно реагируют с водой. Скорость химических реакций зависит от природы реагирующих веществ: так, скорость реакции взаимодействия лития с водой меньше, чем натрия, и еще меньше, чем калия. Взаимодействие рубидия и цезия с водой протекает так быстро, что происходит. Уравнения же реакций щелочных металлов с растворами кислот и солей записывать не принято (так как они взаимодействуют с водой).
Рассмотрите таблицу представленную вашему вниманию ниже:

Качественные реакции на соли (катионы) щелочных металлов

Задание на закрепление:
Осуществить цепочку превращений:
Натрий-----пероксид натрия------оксид натрия------гидроксид натрия--------хлорид натрия
Ваша задача написать 4 уравнения реакций.
Домашнее задание: параграф 11, упр.1 а
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|