
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Занятие № 5. Преподаватель: Бережная Наталья Владимировна.. Практическая работа № 2. Примеры решения задач
Занятие № 5
Дисциплина: ЕН.03 Химия
Группа: ЗТПОП-20
Дата: 08.12. 2020г.
Преподаватель: Бережная Наталья Владимировна.
Тема: Практическая работа № 2 «Вычисление рН в водных растворах кислот и оснований».
Задание: выполнить практическую работу на листе формата А-4, ознакомиться и записать примеры решений задач, ответить на контрольные вопросы. Фото выполненной работы прислать мне по адресу: https://vk.com/id127339568 (Название файла с ответами: № занятия, дисциплина, группа, Фамилия, имя студента. Например: ЕН.03 Химия, ЗТПОП-20, Сидоров М.).
Сроки выполнения: 09.12.2020г.
Практическая работа № 2
Тема: «Вычисление рН в водных растворах кислот и оснований».
Цель работы: научиться решать задачи на вычисление рН в водных растворах кислот и оснований.
Ход работы:
Расчёт pH в водных растворах
| Состав раствора | Расчетная формула |
| Сильная кислота | рH = – lgCк-ты |
| Сильное основание | рН = 14 – рОН = 14 + lgСосн. |
| Слабая кислота | 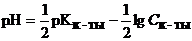
|
| Слабое основание | 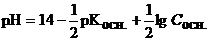
|
| Буферный раствор, состоящий из слабой кислоты и ее соли | 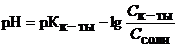
|
| Буферный раствор, состоящий из слабого основания и его соли | 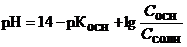
|
Примеры решения задач
Задача 1. Масса гидроксида калия, содержащаяся в 10 л. его раствора, значение рН которого равно 11 составляет 0,56 г 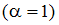 .
.
Решение:
Согласно формуле 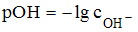 для сильного основания (КОН)
для сильного основания (КОН)  моль/л. Следовательно,
моль/л. Следовательно, 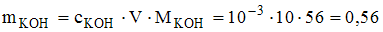 г.
г.
Задача 2. Масса уксусной кислоты, содержащаяся в 5 л ее раствора, значение рН которого равно 3,9, составляет 0,264 г 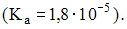
Решение:
Согласно формуле 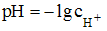 и закону разбавления Оствальда для слабой уксусной кислоты
и закону разбавления Оствальда для слабой уксусной кислоты 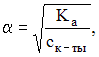 получаем
получаем 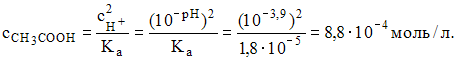
Следовательно, 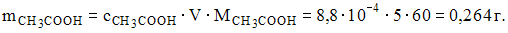
Задача 3. При разбавлении ацетатного буферного раствора в два раза значение величины 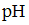 практически не изменяется.
практически не изменяется.
Решение:
При разбавлении буферных растворов, а также при добавлении к ним небольших количеств щелочи или кислоты значение величины 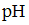 практически не изменяется.
практически не изменяется.
Задача 4. Значение рН раствора, полученного путем разбавления 0,1 М раствора гидроксида калия в 100 раз (α=1), равно 11
Решение:
После разбавления 0,1 М раствора гидроксида калия в 100 раз его концентрация станет равна 0,001 М. С учетом полной диссоциации значение рН вычисляем по формуле 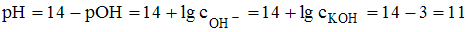 .
.
5. Значение рН раствора, полученного при смешении равных объемов 0,02 М раствора гидроксида натрия и 0,02 М раствора серной кислоты (α = 1), равно 2
Решение:
При смешении данных растворов происходит реакция
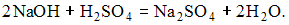 Избыточная концентрация
Избыточная концентрация 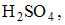 равная 0,01 М, в результате увеличения объема уменьшится в 2 раза и станет равной 0,005 М.
равная 0,01 М, в результате увеличения объема уменьшится в 2 раза и станет равной 0,005 М. 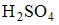 – сильная кислота, для вычисления значения рН можно использовать формулу
– сильная кислота, для вычисления значения рН можно использовать формулу 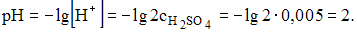
Задача 6. Значение рН раствора, полученного путем разбавления 0,1 М раствора азотной кислоты в 100 раз (α=1), равно 3
Решение:
После разбавления 0,1 М раствора азотной кислоты в 100 раз ее концентрация станет равна 0,001 М. С учетом полной диссоциации значение рН вычисляем по формуле 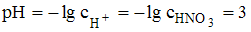 .
.
Задача 7. Масса азотной кислоты, содержащаяся в 5 л ее раствора, значение рН которого равно 3, составляет 0,315г 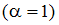 .
.
Решение:
Согласно формуле 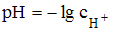 для сильной азотной кислоты,
для сильной азотной кислоты, 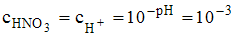 моль/л. Следовательно,
моль/л. Следовательно, 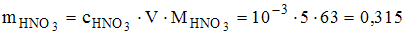 г.
г.
8. Формула вещества, 0,01 М раствор которого характеризуется наименьшим значением рН, имеет вид
… 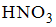 и
и 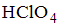
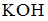 ,
, 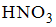 ,
, 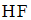 ,
, 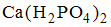
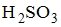 ,
, 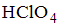 ,
, 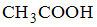 ,
, 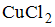
Решение:
Наименьшими значениями рН обладают растворы сильных кислот. В данном случае это раствор 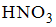 и
и 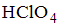 .
.
Расчёты, основанные на произведении растворимости осадков
Расчетные формулы:



 АmBn (т) Аm Bn (р-р) mAn+ + nBm-, тогда произведение растворимости рассчитывается по формуле:
АmBn (т) Аm Bn (р-р) mAn+ + nBm-, тогда произведение растворимости рассчитывается по формуле:
ПР (АmBn) = [Аn+]m × [Bm+]n = const
Растворимость осадка рассчитывается по общей формуле:
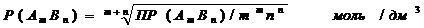
Растворимость осадка состава АВ вычисляют по уравнению:
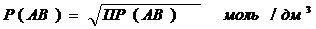
Растворимость осадка состава А2В или АВ2 рассчитывают по формуле:
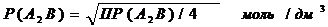
Контрольные вопросы
1.Что называется водородным показателем?
2.Как изменяется величина водородного показателя в кислой среде? в щелочной среде?
3.Почему окраска индикатора изменяется при изменении реакции среды?
4.В какой области находится рН водных растворов солей А1С13, Na3PO4, NaHCO3, K2S?
5.Какую реакцию среды будут иметь следующие растворы солей: Na2S, Zn(NO3)2, KNO3, CuSO4, Cr2(SO4)3? Для солей, подвергающихся гидролизу, составьте молекулярные и ионные уравнения реакций.
Критерии оценивания:
5 баллов – за развернутый, точный и полный ответ в пределах оговоренного объема;
4 балла – допускаются несколько неточностей в ответе или излишне длинный ответ;
3 балла – ответ отличается недостаточной глубиной и полнотой раскрытия вопроса;
2 балла – допускаются серьезные ошибки в содержании ответа;
1 балл – полное незнание изученного материала;
0 баллов – за полное отсутствие ответа.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|