
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примерное время выполнения задания – 2 - 3 минуты
| Задание 29. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. |
Задание № 29 направлено на проверку понимания понятия «избыток», умения вычислять массу, объем или количество вещества по известному количеству вещества, массе или объему одного из участвующих в реакции веществ, умения составлять уравнения химических реакций и решать пропорции.
Примерное время выполнения задания – 2 - 3 минуты
Уровень сложности задания – базовый
Максимальный балл за выполнение задания - 1
Задание состоит из расчетной задачи с описанием простейшего химического процесса. Чтобы выполнить задание, необходимо провести математические расчеты. В ответе надо записать число, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответов указывать не нужно.
| Перед выполнением предложенных заданий повторите: |
Примеры решения задач
1. Рассчитайте массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н.у.) хлора. (Запишите число с точностью до целых.)
Запишем уравнение реакции: 2Al + 3Cl2 = 2AlCl3.
n(Cl2)=2,24л/22,4л/моль=0,1моль
n(AlCl3)=2∗n(Cl2)3=2∗0,13=0,067моль
m(AlCl3)=n(AlCl3)∗M(AlCl3)=0,067 моль∗133,5 г/моль=8,94г ≈9г
2. Рассчитайте объём (н.у.) газа, выделяющегося при действии серной кислоты на 10 г сульфида алюминия. (Запишите число с точностью до сотых.)
Запишемуравнениереакции: Al2S3 + 3H2SO4 = Al2(SO4)3 + 3H2S.
n(Al2S3)=m(Al2S3)M(Al2S3)=10г/150г/моль=0,067 моль
n(H2S)=3∗n(Al2S3)=0,067моль∗3=0,2моль
V(H2S)=n(H2S)∗Vm=0,2моль∗22,4л/моль=4,48л
Задания для подготовки
1.Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н. у.) сероводорода.
2.Рассчитайте объём (н. у.) ацетилена, который выделится при взаимодействии с водой 50 г карбида кальция, содержащего 8 % примесей. Ответ укажите в литрах с точностью до десятых.
3.Вычислите массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора. Ответ укажите в граммах с точностью до целых.
4.Вычислите массу железной окалины, образующейся при сгорании в кислороде 5,1 г железа. Ответ укажите в граммах с точностью до целых.
5.Вычислите массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). Ответ укажите в граммах с точностью до целых.
6.Вычислите объём (н. у.) кислорода, необходимый для полного сгорания 4,6 г этанола. Ответ укажите в литрах с точностью до сотых.
7.Вычислите массу хлорида алюминия, образующегося при действии избыт-ка хлора на 2,7 г алюминия. Ответ укажите в граммах с точностью до сотых.
8.Литий массой 3,5 г сожгли в кислороде. Вычислите массу оксида лития, образовавшегося при этом. Ответ укажите в граммах с точностью до десятых.
9.Вычислите объём (н. у.) газа, выделяющегося при действии соляной кис-лоты на 10 г сульфида алюминия. Ответ укажите в литрах с точностью до сотых.
10.Вычислите массу кислорода, необходимого для полного сжигания 2,24 л (н. у.) угарного газа. Ответ укажите в граммах с точностью до десятых.
11.Вычислите объём (н. у.) хлора, необходимый для полного окисления 12,7 г дихлорида железа. Ответ укажите в литрах с точностью до сотых.
12.Вычислите объём (н. у.) оксида азота(II), который образуется при полном растворении 93,15 г свинца в разбавленной азотной кислоте. Ответ дайте в литрах с точностью до сотых.
13.Вычислите объём (н. у.) сернистого газа, который образуется при сжигании 300 г пирита (дисульфида железа(II)) в избытке кислорода. Ответ дайте в литрах с точностью до целых.
14.Для полного восстановления раскалённого оксида свинца(II) до металла потребовалось 4,48 л аммиака (в пересчёте на н. у.). Вычислите массу образовавшегося свинца. Ответ дайте в граммах с точностью до десятых.
15.При растворении серы в концентрированной серной кислоте образовался газ объёмом 26,88 л (в пересчете на н. у.). Вычислите массу серы (в граммах), вступившей в реакцию. Ответ дайте с точностью до десятых.
16.Вычислите объём азота (при н. у.), который необходимо взять для получения 17 г аммиака при условии количественного выхода. Ответ укажите в литрах с точностью до десятых.
17.Вычислите массу соединения, образовавшегося в результате сгорания в избытке кислорода 18,4 г металлического натрия. Ответ укажите в граммах с точностью до десятых.
18.Вычислите массу соли, образовавшейся при поглощении 5,6 л (н. у.) углекислого газа избытком гидроксида бария. Ответ укажите в граммах с точностью до десятых.
19.Вычислите объём газа, который выделится при взаимодействии 10 моль пероксида натрия с избытком углекислого газа. Ответ укажите в литрах с точностью до целых.
20.Вычислите объём газа (н. у.), образовавшийся в результате растворения 40 г карбоната кальция в избытке соляной кислоты. Ответ укажите в литрах с точностью до десятых.
21.Вычислите объём хлора (н. у.), который необходим для образования из железа хлорида железа(III) массой 65 г. Ответ укажите в литрах с точностью до сотых.
22.Вычислите объём газа (н. у.), который выделится при растворении 28,0 г железа в соляной кислоте. Ответ укажите в литрах с точностью до десятых.
23.Вычислите объём газа, образовавшийся в результате растворения 50 г карбоната кальция в избытке соляной кислоты. Ответ укажите в литрах с точностью до десятых.
24.Вычислите объём газа, образовавшийся в результате растворения 40 г карбоната магния в избытке соляной кислоты. Ответ укажите в литрах с точностью до целых.
25.При полном разложении навески дихромата аммония масса твёрдого остатка составила 38,0 г. Вычислите объём образовавшегося при этом азота (в пересчёте на н. у.). Ответ дайте в литрах с точностью до десятых.
26.При растворении серебра в разбавленной азотной кислоте выделился оксид азота(II) объёмом 3,36 л (в пересчёте на н. у.). Вычислите массу образовавшейся соли (в граммах). Ответ дайте с точностью до десятых.
27.Вычислите массу дихромата калия, который потребуется для получения 13,44 л (н. у.) хлора при взаимодействии с концентрированной соляной кислотой. Ответ дайте в граммах с точностью до десятых.
28.Вычислите объём хлора (н. у.), который выделится при взаимодействии 47,4 г перманганата калия с избытком концентрированной соляной кислоты. Ответ дайте в литрах с точностью до десятых.
29.Вычислите объём (в литрах при н. у.) кислорода, который образуется при разложении 4 моль пероксида водорода. Ответ дайте с точностью до десятых.
30.Вычислите массу перманганата калия, который необходимо прокалить для получения 6,72 л (н. у.) кислорода. Ответ дайте в граммах с точностью до десятых.
31.При разложении перекиси водорода образовалось 10,08 л (н. у.) кислорода. Вычислите массу перекиси, которая вступила в реакцию. Ответ дайте в граммах с точностью до десятых.
32.Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте с точностью до десятых.
33.Рассчитайте массу (в граммах) железной окалины, образующейся при сгорании в кислороде 5,1 г железа.(Запишите число с точностью до сотых.)
34.Вычислите массу цинка, который вступает в реакцию с соляной кислотой для получения 2,24 л (н. у.) водорода. Ответ дайте в граммах с точностью до десятых.
35.При растворении железа в горячей концентрированной серной кислоте выделилось 3,36 л газа (н. у.). Вычислите массу железа, которое вступило в реакцию. Ответ дайте в граммах с точностью до десятых.
36.Вычислите массу хлорида натрия, который потребуется для получения 33,6 л хлора (н. у.) с помощью электролиза. Примите 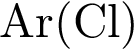 = 35,5. Ответ дайте в граммах с точностью до десятых.
= 35,5. Ответ дайте в граммах с точностью до десятых.
37.При растворении алюминия в концентрированном растворе гидроксида натрия выделилось 10,08 л газа (н. у.). Вычислите массу алюминия, который вступил в реакцию. Ответ дайте в граммах с точностью до десятых.
38.При разложении перманганата калия образовалось 8,96 л кислорода (измерено при н. у.). Вычислите массу перманганата, который вступил в реакцию. Ответ дайте в граммах с точностью до десятых.
39.Вычислите массу перманганата калия, который потребуется для получения 11,2 л хлора (н. у.) из соляной кислоты. Ответ дайте в граммах с точностью до десятых.
40.Вычислите массу хлората калия, который образуется в результате пропускания 13,44 л хлора (н. у.) через избыток горячего раствора гидроксида калия. Примите Ar(Cl) = 35,5. Ответ дайте в граммах с точностью до десятых.
41.При электролизе расплава оксида алюминия на инертном аноде выде-лилось 100,8 л (в пересчёте на н. у.) газа. Вычислите массу металла, который образовался на катоде. Ответ дайте в граммах с точностью до целых.
42.При полном восстановлении оксида железа(III) углеродом выделилось 50,4 л (в пересчёте на н. у.) углекислого газа. Вычислите массу железа, которое при этом образовалось. Ответ дайте в граммах с точностью до целых.
43.При растворении железа в горячей концентрированной азотной кислоте выделилось 16,8 л (н. у.) оксида азота(IV). Сколько граммов железа израсходовано? Ответ округлите до ближайшего целого числа.
44.При растворении серебра в концентрированной азотной кислоте выделилось 33,6 л (н. у.) оксида азота(IV). Сколько граммов серебра израсходовано? Ответ округлите до ближайшего целого числа.
45.Сколько граммов сульфида алюминия требуется для получения 2,24 л (н. у.) сероводорода с помощью реакции гидролиза? Ответ округлите до ближайшего целого числа.
46.Сколько граммов карбида алюминия требуется для получения 5,6 л (н. у.) метана с помощью реакции гидролиза? Ответ округлите до целых.
47.Какая масса соли образуется при взаимодействии 0,4 моль уксусной кислоты с избытком карбоната натрия? (Запишите ответ в граммах с точностью до десятых.)
48.При электролизе раствора сульфата меди(II) на аноде выделилось 3,36 л (н. у.) кислорода. Сколько граммов металла выделилось на катоде? Примите Ar(Cu) = 64. Ответ запишите с точностью до десятых
49.При электролизе раствора нитрата серебра на аноде выделилось 1,12 л (н. у.) кислорода. Сколько граммов металла выделилось на катоде? Ответ запишите с точностью до десятых.
50.Сколько граммов хлората калия образуется при растворении 26,88 л (н. у.) хлора в горячем растворе гидроксида калия? Ответ представьте с точностью до целых.
51.Сколько литров хлора (н. у.) потребуется для получения хлорида железа(III) из 28 г железа? Ответ представьте с точностью до десятых.
52.При сгорании железа на воздухе образовалось 29 г оксида железа(II, III). Сколько литров кислорода (н. у.) израсходовано? Ответ представьте с точностью до десятых.
53.При взаимодействии железа с парами воды выделилось 11,2 л (в пересчёте на н. у.) водорода. Сколько граммов оксида железа(II, III) образовалось? Ответ представьте с точностью до целых.
54.Для полного восстановления раскалённого сульфата бария израсходовано 17,92 л водорода (в пересчёте на н.у.). Сколько граммов сульфида бария образовалось? Ответ запишите с точностью до десятых.
55.При нагревании питьевой соды образовалось 5,6 л (н.у.) оксида углерода(IV). Сколько граммов соды израсходовано? Ответ запишите с точностью до целых.
56.При длительном прокаливании нитрата алюминия получен твёрдый остаток массой 25,5 г. Сколько литров оксида азота(IV) образовалось (в пересчёте на н. у.)? Ответ запишите с точностью до десятых.
57.При длительном прокаливании основного карбоната меди(II) получен твёрдый остаток массой 25 г. Сколько литров углекислого газа образовалось (в пересчёте на н. у.)? Ответ запишите с точностью до десятых.
58.При разложении карбоната аммония образовалась смесь газов, объём которой после конденсации паров воды составил 33,6 л (н. у.). Сколько граммов соли разложилось? Ответ запишите с точностью до целых.
59.При полном термическом разложении нитрата меди(II) образовалась смесь газов объёмом 11,2 л (н. у.). Чему равна масса твёрдого остатка (в граммах)? Ответ запишите с точностью до целых. Примите, что  .
.
60.При сгорании натрия в атмосфере хлора образовалось 35,1 г хлорида натрия. Сколько литров хлора (н. у.) израсходовано? Ответ запишите с точностью до сотых.
61.Гидрокарбонат натрия массой 50,4 г прокалили до постоянной массы. Сколько литров углекислого газа (н. у.) в результате образовалось? Ответ запишите с точностью до сотых.
62.Определите объём (н. у.) кислорода (в литрах), который можно получить при полном термическом разложении 338,4 г нитрата меди(II). (Запишите число с точностью до целых.)
63.При растворении железа в горячей концентрированной азотной кислоте выделилось 13,44 л бурого газа (в пересчёте на н. у.). Сколько граммов азотной кислоты израсходовано? Ответ представьте с точностью до десятых.
64.Для растворения образца меди потребовалось 44,1 г азотной кислоты. Сколько литров оксида азота(IV) (н. у.) при этом образовалось? Ответ представьте с точностью до сотых.
65.Сколько литров газа (н. у.) выделится при полном термическом разложении 17 г нитрата натрия. (Запишите число с точностью до сотых.)
66.Сколько литров хлора (в пересчёте на нормальные условия) образуется при взаимодействии 23,7 г перманганата калия с избытком кон-центрированной соляной кислоты? Ответ запишите с точностью до десятых.
67.При взаимодействии перманганата калия с избытком концентрированной соляной кислоты образовалось 16,8 л хлора (н. у.). Вычислите массу перманганата калия. Ответ запишите с точностью до десятых.
68.При взаимодействии водяного пара с раскалённым железом получили 22,4 л водорода (в пересчёте н. у.). Сколько граммов железной окалины ( 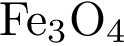 ) при этом образовалось? (Ответ запишите с точностью до целых.)
) при этом образовалось? (Ответ запишите с точностью до целых.)
69.Сколько граммов метанола можно получить при 100%-м выходе из синтез-газа, содержащего 56 л водорода (н. у.)? (Ответ запишите с точностью до целых.)
70.Сколько литров оксида серы(IV) (в пересчёте на н. у.) можно получить при обжиге 22 г сульфида железа(II)? (Ответ запишите с точностью до десятых.)
71.При обжиге сульфида меди(II) образовалось 5,6 л (в пересчёте на н. у.) оксида серы(IV). Сколько граммов сульфида меди(II) вступило в реакцию? (Ответ запишите с точностью до целых.)
72.Определите объём водорода (н. у.), который выделится при взаимодействии 1,875 моль цинка с избытком разбавленного раствора серной кислоты. (Запишите число с точностью до целых.)
73.Какая масса алюминия потребуется для восстановления 0,2 моль оксида железа(III)? (Запишите число с точностью до десятых.)
74.Оксид железа(III) массой 24,0 г восстановили углём до металла. Единственный газообразный продукт реакции — углекислый газ. Чему равен его объём в литрах (н. у.)? Ответ запишите с точностью до сотых. Примите 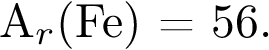
75.Сколько граммов хлорида натрия требуется для получения 6,72 л газообразного хлора (н. у.) методом электролиза? Ответ запишите с точностью до десятых. Примите 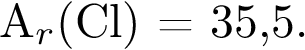
Ответы:
| 14,4 | 16,1 | 6,72 | 13,35 | 7,5 | 4,48 | 1,6 | |||
| 1,12 | 6,72 | 62,1 | 12,8 | 11,2 | 31,2 | 49,3 | 9,0 | ||
| 13,44 | 11,2 | 11,2 | 5,6 | 76,5 | 58,8 | 16,8 | 44,8 | 94,8 | |
| 30,6 | 14,4 | 7,04 | 6,5 | 5,6 | 175,5 | 8,1 | 126,4 | 31,6 | 24,5 |
| 32,8 | 19,2 | 21,6 | |||||||
| 16,8 | 5,6 | 33,8 | 33,6 | 3,5 | 6,72 | ||||
| 6,72 | 7,84 | 2,24 | 8,4 | 47,4 | 5,6 | ||||
| 10,8 | 5,04 | 35,1 | |||||||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|