
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Применение первого закона термодинамики к изопроцессам.
Первый закон термодинамики Необратимость тепловых процессов. Формулировка и уравнение первого закона термодинамики. Решение задач. Обратимые и необратимые процессы их примеры
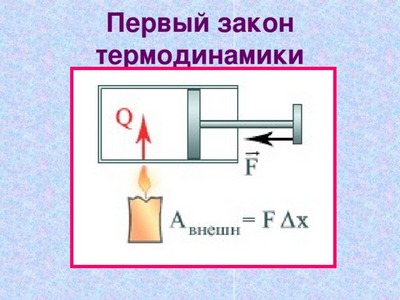
Существует две формы передачи энергии от одних тел к другим —
это совершение работы одних тел над другими
- передача теплоты.
Энергия механического движения может переходить в энергию теплового движения и наоборот. В таких переходах энергии выполняется закон сохранения энергии. В применении к процессам, рассматриваемым в термодинамике, закон сохранения энергии именуется первым законом (или первым началом) термодинамики. Этот закон является обобщением эмпирических данных.
Простая формулировка первого закона термодинамики может звучать примерно так: -------- изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии.
То есть другими словами, чтобы
в системе произошли какие-то изменения необходимо приложить определенные усилия извне.
В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая. То есть на примере пословицы про рыбку и труд, можно представить, что рыбка и есть наша условно закрытая система, в ней не произойдет никаких изменений (рыбка сама себя не вытащит из пруда) без нашего внешнего воздействия и участия (труда).
именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону,
в науке существует целых четыре формулировки сути данного закона:
§ Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
§ Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.
§ Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
§ Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формулу первого закона термодинамики можно записать таким образом:
Q = ΔU + A
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Применение первого закона термодинамики к изопроцессам.
1. Изотермический процесс. Т = const. Изотермический процесс — это процесс, происходящий при постоянной температуре. С учётом того, что количество газа также неизменно, становится ясно, что так как внутренняя энергия зависит от температуры и количества газа, то в этом процессе она не изменяется,
∆T = 0; ∆U =0, Q = A/
1. Изохорный процесс. Изохорный процесс — это процесс, происходящий при постоянном объёме. То есть в этом процессе газ не расширяется и не сжимается, а значит не совершается работа ни газом, ни над газом,
∆V = 0; A/ =0.
Q = ∆U.
1. Изобарный процесс. Изобарный процесс — это процесс, при котором давление газа неизменно, но и температура, и объём изменяются,
Р = const; A/>0, ∆U>0
Q = ∆U + A/.
Используя уравнение Менделеева-Клапейрона, получим
υR(T2 – Т1) = P(V2-V1) = P∙∆V;
Подстановка в уравнение первого закона термодинамики количества теплоты дает
1. Адиабатный процесс. Адиабатный процесс — это процесс, при котором теплообмен газа с окружающей средой отсутствует (либо газ находится в теплоизолированном сосуде, либо процесс его расширения или сжатия происходит очень быстро).
. Q = 0.
Тогда система может совершать работу либо за счет уменьшения внутренней энергии (газ расширяется)
A/ = - ∆U,
либо за счет работы внешних тел над системой (происходит сжатие газа)
А = ∆U.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|