
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
хлорид-анион Cl– — соляной кислоты(остальные см.табл.,учить названия).
Кислоты.
Кислоты – сложные соединения, состоящие из:
1.на первом месте катион водорода (один или несколько) H+
2.на втором месте анион кислотного остатка, например,
-сульфат-анион SO42– — «остаток» серной кислоты,
-хлорид-анион Cl– — соляной кислоты(остальные см.табл.,учить названия).
*Общая формула кислот HmAc, где (Ас) - кислотный остаток.
Классификация кислот.
По содержанию кислорода и основности (числу атомов водорода).
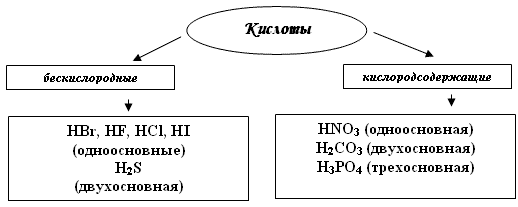
Назовите кислоты в таблице.
Кислородсодержащие кислоты имеют сложный кислотный остаток. Степень окисления кислотного остатка относится полностью к нему, как к единому целому. Какова степень окисления таков и индекс у катиона водорода( Число атомов водорода в кислоте определяют по степени окисления кислотного остатка, и наоборот - степень окисления кислоты определяют по числу катионов водорода).
Кислоты можно классифицировать ещё по ряду признаков:
1. по растворимости:- не растворимые (кремниевая H2SiO3)
- растворимые (все остальные)
2. по летучести (неустойчивости):
- летучие (HNO3, H2SO3, HCl, H2CO3, H2S) дать названия кислотам
- нелетучие (все остальные)
Как правило, кислоты образуют неМе. То есть кислоты есть гидроксиды оксидов неМе - оксид неМе + вода.
Сернистая кислота H2SO3 соответствует оксиду серы (VI) SO3
Какая кислота соответствует оксиду азота (V) N2O5?
Какая кислота соответствует оксиду углерода (IV) CO2?
Какая кислота соответствует оксиду фосфора (V) P2O5?
Пример: -Найти степень окисления кислотообразующего ХЭ можно, зная, то молекула электронейтральна, то есть её заряд равен нулю.
-Определите степени окисления атомов кислотообразующих элементов в следующих кислотах: HNO2, H2SiO3, HClO3, H3PO3, H3PO4.
Домашняя работа: выучить кислоты, уметь определять степени окисления кислотообразующего ХЭ, учить параграф 21 или этот конспект, письменно:


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|