
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3. Приготовление раствора заданной концентрации. Ход практической работы.. Приготовление раствора соли с определенной массовой долей растворенного вещества.
При оформлении протокола укажите дату занятия, название и цель практического занятия, оборудование и реактивы.
В ходе практической работы напишите пошагово отчет о проделанной работе.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3
Приготовление раствора заданной концентрации
Цель занятия: Овладение навыками приготовления растворов определенного объема с заданной молярной концентрацией, с соблюдением правил техники безопасности.
Оборудование и реактивы: весы, мерный цилиндр, химический стакан, ложка, стеклянная палочка, кристаллический хлорид натрия NaCl, вода.
Ход практической работы.
Приготовление раствора соли с определенной массовой долей растворенного вещества.
1. Приготовить 50 г раствора с массовой долей хлорида натрия 20%.
2. Для этого необходимо рассчитать массу вещества и растворителя, необходимых для приготовления заданного объема раствора с заданной массовой долей растворенного вещества.
| Дано | Найти | Расчет по формуле |
| ω (%) | m в-ва (г) | m (в-ва) = m (р-ра)* ω |
| m р-ра (г) | V Н2О (мл) | m (Н2О) = m (р-ра) -m (в-ва); V Н2О = m/ρ. ρ – плотность, для воды составляет 1г/см3 |
ω - массовая доля - это отношение массы растворенного вещества к массе раствора. Выражается в процентах (%).
m в-ва – масса растворенного вещества. Выражается в граммах (г).
m (р-ра) – масса раствора. Выражается в граммах (г).
V Н2О – объем воды, которая является растворителем. Выражается в литрах (л).
а). Определить массу растворенного вещества (соли), которая необходима для приготовления раствора по формуле:
m (в-ва) = m (р-ра)* ω.
б). Найти массу воды. Поскольку масса раствора состоит из массы растворенного вещества и массы воды, то масса воды равна разнице между массой растворенного вещества и массой раствора.
m (Н2О) = m (р-ра) -m (в-ва).
в). Вычислить объем воды, так как взвешивать воду на весах нельзя. Плотность воды при температуре +25°С равна 1 г/см3.
V Н2О = m/ρ.
3. Взвесить на весах рассчитанную массу соли (навеску) согласно правилам работы с электронными весами.
4. Перенести навеску соли в стаканчик.
5. Налить в мерную колбу рассчитанный объем воды по нижнему мениску.
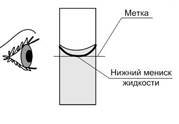
6. Прилить в стаканчик с солью воду из мерной колбы и перемешать стеклянной палочкой до полного растворения вещества.
7. Сделать вывод.
Пример расчетов.
| Содержание задачи | Приготовить 10 г раствора с массовой долей хлорида натрия 10%. |
| Расчёты | Дано: m(р-ра)=10 г; ω(NаCl)=10%=0,1. Найти: m (NaCl)-?; V(Н2О)-? Решение: 1. m (NaCl)= m (р-ра)* ω=10 г*0,1=1 г. 2. m (Н2О) = m (р-ра) - m (NаCl)=10 г – 1 г = 9 г. V Н2О = m/ρ=9 г*1г/см3=9 см3. |
| Вывод | Для приготовления 10 г раствора хлорида натрия с массовой долей _10__% нужно взять __1_ г NaCl и растворить в_9__ мл воды. |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|