
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Общие свойства переходных металлов
Общие свойства переходных металлов
Переходные элементы располагаются в побочных подгруппах Периодической системы Д.И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы. Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство.
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается. См. Табл. 1. Химические свойства переходных элементов довольно сложны.
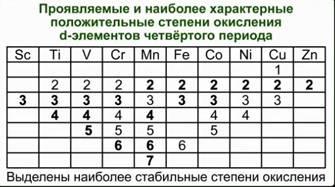
Табл. 1
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|