
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задание для самостоятельной работы.
Отчет по работе №2
Определение тепловых эффектов химических реакций. Оценка возможности самопроизвольного протекания процесса
Задание 1
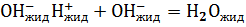
1) 𝛥rH0=Σν𝛥fHпродуктов - Σν𝛥fHисходных
𝛥rH0=1·(-286,0)-[(1·0)+(1·(-230,0))]= -56,0 кДж (р-я экзотермическая)
2) 𝛥rS0=Σν·S0продуктов - Σν·S0исходных
𝛥rS0=(1·70,0)-[(1·0)+(1·(-10,5))]=80,5 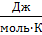 =0,0805
=0,0805 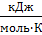
3) 𝛥rG0= 𝛥rH0-T· 𝛥rS0
𝛥rG0=(-56,0)-(298·0,0805)=-80,0 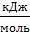
Таким образом, в неизолированной системе при Т=const, p=const самопроизвольное протекание реакции 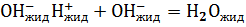 возможно.
возможно.
Задание 2
H2SO4+2NaOH=Na2SO4+2H2O
mстакана=180,25 г.;
tначальная=22,0°С=320,0 К
tконечная=28,0°С=326,0 К
1. Расчет разницы температур:
Т(К)= tконечная - tначальная
Т(К)= 326,0-320,0=6,0 К
2. Расчет суммарной массы раствора:
mраствора=(Vщелочи+Vкислоты)·ρраствора
где, ρраствора=1 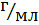
mраствора=(100+100)·1=200 г
3. Расчет теплоемкости системы:
Сm=Сраствора· mраствора+Сстакана· mстакана
где, Сраствора-удельная теплоемкость раствора, Сраствора=4,184 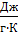
Сстекла-удельная теплоемкость стекла, Сстекла=0,753 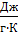
Сm=(4,184·200)+(0,753·180,25)=972,5 
4. Расчет количества тепла, выделившегося в калориметре:
q= Сm·𝛥T
q=972,5·6.0=5833,8 Дж = 5,8кДж
5. Расчет числа моль полученной воды, равной числу моль нейтрализованной щелочи:
νН2О=Сщелочи·Vщелочи
где, Сщелочи –молярная концентрация щелочи. Сщелочи=1,0 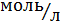
νН2О=1,0·0,1=0,1 моль
6. Расчет теплового эффекта реакции нейтрализации:
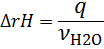
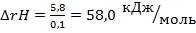
Таким образом, реакция H2SO4+2NaOH=Na2SO4+2H2O является эндотермической, т.е. протекает с поглощением теплоты.
Рассчитаем теплоту химической реакции по формуле:
𝛥rH0=Σν𝛥fHпродуктов - Σν𝛥fHисходных
и сравним с количеством теплоты нейтрализации, полученной практическим методом.
𝛥rH0=(-1385,0)+(2·(-286,0))-(2·(-426,0))+(-811,3)=-293,7 кДж - реакция экзотермическая, т.е. протекает с выделением теплоты.
Задание для самостоятельной работы.
Задание 1.
Вычислить тепловой эффект реакции разложения 200 г СаСО3. Ответ подтвердить расчетом и указать, от каких факторов зависит величина теплового эффекта.
СаСО3(кристалл)=СаО(кристалл)+СО2(газ)
1) 𝛥rH0=Σν𝛥fHпродуктов - Σν𝛥fHисходных
𝛥rH0=[(-635)+(-394)]-(-1206)=177кДж (р-я эндотермическая)
Согласно уравнению реакции, в процессе разложения участвует 1 моль СаСО3. Рассчитаем количество моль, содержащихся в 200 г СаСО3
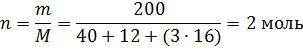
Таким образом, если в реакцию вступят 2 моль СаСО3, что в 2 раза больше, то и теплоты поглотится в 2 раза больше:
𝛥rH0=177·2=354 кДж
В данном примере величина теплового эффекта зависит от количества исходного вещества
Задание 2.
Определить тепловой эффект реакции при образовании 1 моль воды. Ответ подтвердить расчетом.
4NH3+5O2=4NO+6H2O
𝛥rH0=Σν𝛥fHпродуктов - Σν𝛥fHисходных
𝛥rH0=[(4·(-94))+(6·(-242))]-[(4·(-46))+(5·0)]=-1644 кДж (р-я экзотермическая)
Согласно уравнению химической реакции образуется 6 моль воды и при этом выделяется 1644 кДж тепла. Если в ходе химической реакции образуется 1 моль воды, что в 6 раз меньше, то и теплоты выделится в 6 раз меньше. Таким образом:
𝛥rH0=-1644:6=-274 кДж
Задание 3.
Определить изменение энергии Гиббса при гидролизе карбамида. Ответ подтвердить расчетом и указать в каком направлении возможно его самопроизвольное протекание в стандартных изобарно-изотермических условиях.
СО(NH2)2+H2O=CO2+2NH3
1) 𝛥rH0=Σν𝛥fHпродуктов - Σν𝛥fHисходных
𝛥rH0=[(-394+(2·(-46))]-[(-33)+(-285)]=-168 кДж (р-я экзотермическая)
2) 𝛥rS0=Σν·S0продуктов - Σν·S0исходных
𝛥rS0=[214+(2·193)]-(105+70)=425 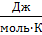 =0,425
=0,425 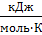
3) 𝛥rG0= 𝛥rH0-T· 𝛥rS0
𝛥rG0=(-168)-(298·0,425)= -295 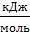
Таким образом, в неизолированной системе при стандартных изобарно-изотермических условиях возможно протекание реакции СО(NH2)2+H2O=CO2+2NH3 в прямом направлении.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|