
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Группа: 11э, 12э ДОУ«Физико-хичим.метод анализа нефти и нефтепродуктов»
Группа: 11э, 12э ДОУ«Физико-хичим.метод анализа нефти и нефтепродуктов»
25.11.2020 год
Тема:«Классификация химических реакций»
Цель урока: тестовый контроль знаний, как средство совершенствования системы проверки и оценки результатов обучения
:
Ход урока
Использование промежуточных тестов при актуализации знаний очень эффективно. Также считаю, целесообразным применение тестов на этапе закрепления и при выполнении домашнего задания, где возможны элементы дифференциации.
Вариант - 1 (выполняют те, кто по списку с 1 по 15)
1) Реакцией обмена является:
а) BaO + HOH →;
б) H2SO4 + Zn →;
в) HNO3 + Ca(OH)2 →;
г) N2 + O2 →
2) Обратимой реакцией является
а) HCl + KOH → KCl + H2O;
б) N2 + O2 → 2NO;
в) C(тв.) + O2 → CO2;
г) BaCl2 + 2AgNO3 → 2AgCl + Ba(NO3)2
3) Эндотермическими реакциями являются:
а) CaCO3 = CaO + CO2 –Q;
б) 2H2O2 → 2Н3O + O2 +Q
в) N2 + O2 → 2NO –Q;
г) 2SO2 + O2 → 2SO3 + Q
4) Катализатор – это …
а) замедлитель реакций, который вступает в реакцию с исходными веществами;
б) ускоритель реакций, который вступает в реакцию с исходными веществами;
в) ускоритель реакций, который не расходуется и в состав продуктов не входит;
г) средство контроля за протеканием химической реакции.
5) Гомогенной реакцией является:
а) 2H2O2(ж) ↔ 2Н2O (ж) + O2(г) ;
б) CH₄(г) + 2O₂(г) → CO₂(г) + 2H₂O(пар);
в) 2Al(тв) + 3Сl2(г) → 2AlСl3(тв);
г) Сa(тв) + 2HCl(ж) → CaCl2(ж) + Н2(г)
6) Не окислительно-восстановительной реакцией является
а) 2С + О2 → 2СО;
б) N2 + O2 → 2NO
в) BaO + SO2 → BaSO3;
г) 2Al + 6HCl → 2AlCl3 + 3H2
7) Реакцией разложения является:
а) 2Mg + O2 → 2MgO;
б) (CuOH)2CO3 = 2CuO + CO2 + H2O;
в) 3O2 → 2O3;
г) CH₄ + 2O₂ → CO₂ + 2H₂O
8) Реакцией, протекающей без изменения состава веществ, является
а) N2 + O2 → 2NO;
б) P4 ↔ 4P;
в) 2С + О2 → 2СО;
г) N2 + 3H2 → 2NH3
9) Допишите уравнения реакций и определите их тип (р.р., р.с., р.з., р.о.):
а) FeCl3 + NaOH →
б) Al2O3 →
в) Mg + HNO3 →
г) P + O2 →
10) Вытеснение более активными металлами менее активных из их оксидов – это …
а) оксидирование;
б) горение;
в) металлотермия;
г) металлопластика.
11) Правило Бертолле гласит:
а) Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
б) Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате неё.
в) Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа равные стехиометрическим коэффициентам.
г) Реакции между растворами электролитов протекают до конца, если образуется осадок, газ или малодиссоциирующее вещество.
Вариант - 2(выполняют те, кто по списку с 16 и до конца)
1) Экзотермическими реакциями являются:
а) Mg + 1/2O2 → MgO + 614 кДж; б) H2 + O2 → 2H2O -484 кДж;
в) г) CH₄ + 2O₂ → CO₂ + 2H₂O +891кДж; г) 2C + 2H2 → C2H4 -55 кДж
2) Ингибитор – это …
а) реагент, который замедляет или останавливает химическую реакцию;
б) реагент, который ускоряет химическую реакцию;
в) реагент, который отслеживает наличие в реакционной системе побочных продуктов;
г) средство контроля за протеканием химической реакции.
3) Реакцией замещения является
а) Na2O + HOH →; б) H2SO4 + Al →; в) AgNO3 + CaCl2 →; г) N2 + H2 →
4) Необратимой реакцией является:
а) K2CO3 + HCl → KCl + CO2 + H2O; б) N2 + O2 → 2NO;
в) SO2 + 1/2O2 → SO3; г) N2 + 3H2 → 2NH3
5) Окислительно-восстановительной реакцией является:
а) СO2 + Na2О → Na2СО3; б) 2Al + 6HCl → 2AlCl3 + 3H2
в) BaCl2 + K2SO4 → BaSO4 + 2KCl; г) 2HNO3 + CaO → Ca(NO3)2 + H2O
6) Гетерогенной реакцией является:
а) 2H2(г) + O2(г) ↔ 2Н2O (пар) ; б) CH₄(г) + 2O₂(г) → CO₂(г) + 2H₂O(пар);
в) Al(тв) + 3HCl(ж) → AlCl3(ж) + 1/2Н2(г) г) 2Al(тв) + 3I2(тв) → 2AlI3(тв)
7) Реакцией, протекающей без изменения состава веществ, является:
а) 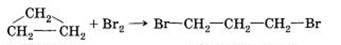 б)
б) 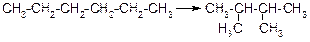
в) 3C2H2 → C6H6; г) S + O2 → SO2
8) Реакцией соединения является:
а) 2CrO + 1/2O2 → Cr2O3; б) (CuOH)2CO3 → 2CuO + CO2 + H2O;
в) P4 → 4P; г) C2H₄ + 3O₂ → 2CO₂ + 2H₂O
9) Допишите уравнения реакций и определите их тип (р.р., р.с., р.з., р.о.):
а) Na + HOH →
б) Fe(OH)3 →
в) Li + O2 →
г) H3PO4 + NaOH→
10) Взаимодействие сильных кислоты и основания с образованием соли и воды – это …
а) выщелачивание; б) нейтрализация; в) окисление; г) кислотно-основное титрование.
11) Закон постоянства состава гласит:
а) Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа равные стехиометрическим коэффициентам.
б) Реакции между растворами электролитов протекают до конца, если образуется осадок, газ или малодиссоциирующее вещество.
в) Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
г) Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате неё.
Домашнее задание:
- ответить на тестовое задание:
Вариант - 1 (выполняют те, кто по списку с 1 по 15)
Вариант - 2(выполняют те, кто по списку с 16 и до конца)
Срок выполнения: 25.11.2020 до 14.00 часов
Информация для студентов для обратной связи с Вами: (создание конференций): https://vk.com/club200092910 - «Физико-хичим.метод анализа нефти и нефтепродуктов 11э, 12э»
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|