
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примеры расчетов
Тема: «Основы химической термодинамики»
Термодинамика базируется на двух основных законах, называемых первым и вторым началом термодинамики. При приложении первого начала термодинамики к химическим процессам особое внимание уделяем закону Гесса, позволяющему вычислить тепловой эффект реакции. Задача заключается в том, чтобы усвоить смысл закона и научиться вычислять тепловые эффекты реакции, пользуясь справочными таблицами стандартных теплот образования и стандартных теплот сгорания соединений. Важно знать зависимость теплового эффекта от температуры (закон Киргоффа), позволяющую вычислить тепловой эффект реакции при любой температуре, если известны теплоемкости исходных веществ.
При изучении второго начала термодинамики необходимо усвоить физический смысл закона, разобрав его формулировки. Важно понять физический смысл энтропии. Исходя из второго закона термодинамики надо уметь показать, что в изолированных системах энтропия определяет направление процесса и состояние равновесия, в неизолированных системах при соответствующих условиях напрвление процесса определяют соответствующие потенциалы: F (при V=cоnst, T=const),G (при P=cоnst, T=const).
Тема: «Химическое равновесие»
При изучении данной темы следует обратить внимание на понятия равновесия, равновесного состава системы, константы равновесия химического процесса. Необходимо четко понимать, что химические реакции в реакционной смеси протекают самопроизвольно до тех пор, пока в ней не будет достигнуто химическое равновесие. Нужно уметь использовать принцип Ле-Шателье для определения влияния на химическое равновесие изменений внешних условий. Следует уметь выводить уравнения изотермы и изобары химической реакции и пользоваться ими для расчета возможности протекания реакции в данных условиях, определения константы равновесия, и, следовательно, выхода продукции при различных условиях.
Контрольные вопросы:
1. Основные понятия и определения химической термодинамики. Первое начало термодинамики.
2. Теплоемкость. Влияние температуры на теплоемкость. Зависимость теплового эффекта химической реакции от температуры. Уравнение Киргоффа.
3. Самопроизвольные и несамопроизвольные процессы. Второе начало термодинамики. Энтропия.
4. Изменение энтропии как критерий направления процессов в изолированной системе.
5. Химическое равновесие. Закон действующих масс. Константа равновесия. Уравнение изотермы химической реакции.
6. Влияние температуры на химическое равновесие. Уравнение изобары химической реакции.
Примеры расчетов
Для определения термодинамических параметров химических реакций нужно знать свойства веществ, участвующих в реакции. Термодинамические свойства индивидуальных веществ: ∆H0f,298 - стандартная теплота образования, S0298 - абсолютная энтропия, Ср° - теплоемкость приведены в справочной литературе.
Пример 1. Вычисление ∆Н0298 - теплового эффекта реакции.
2Н2 + СО = СН3ОН(газ) при температуре Т = 298 К
∆Н0298 = ∆Н 0f,298(СН3ОН) - ∆Н0f,298(СО) – 2∆Н 0 f,298(Н2)
∆Н0298 = –201,00 – (–110,53) – 2 ⋅ 0 = –90,47 кДж/моль
Тепловой эффект реакции получился отрицательным, это означает, что в результате данной реакции тепло выделяется, т.е. реакция является экзотермической.
Пример 2. Вычисление ∆S 0298 - изменения энтропии при протекании в системе реакции
2Н2 + СО = СН3ОН(газ) при температуре Т = 298 К.
Изменение энтропии в системе при протекании реакции в стандартных условиях (∆S0298) есть разность абсолютных энтропий продуктов реакции и исходных веществ.
∆S0298 = S0298,СН3ОН – S0 298,СО – 2S0298,О2
∆S0298 = (239,76 – 197,55 – 2 ⋅ 130,52) Дж/(моль⋅К)
∆S0298 = –218,83 Дж/(моль⋅К) = –0,219 кДж/(моль⋅К)
∆S 0298 получилась отрицательной, это означает, что энтропия системы уменьшится, если в ней произойдет данная реакция. Этот результат можно было предвидеть заранее, так как из уравнения реакции видно, что из трех молей газообразных веществ получается 1 моль, что должно привести к уменьшению хаотичности системы.
Пример 3. Вычисление ∆G 0 298 - стандартного изобарного потенциала химической реакции
2Н2 + СО = СН3ОН(газ) .
Согласно известным термодинамическим соотношениям
∆G 0 T = ∆H 0T – T · ∆S 0T, (1.1.1)
т.е. при Т = 298 К имеем:
∆G 0 298 = ∆H 0298 – 298∆S 0298 = [(–90,47 – 298·(–0,219)] кДж/моль
∆G 0 298 = –25,21 кДж/моль.
Пример 4. Вычисление К0 - константы равновесия химической реакции
2Н2 + СО = СН3ОН(газ)
По уравнению изотермы химической реакции
∆G 0 T = –RT lnK0 (1.1.2)
Следовательно, при Т = 298 К имеем:
| ln K 0 = | −∆G 0 398 | = | 25,21 | = | 10,18 |
| R ⋅ 298 | 8,31⋅10-3⋅298 |
Так как ln K0 = 10,18; K0 = e 10,18 = 2,6⋅104 .
Какие выводы можно сделать из полученного численного значения константы равновесия?
| (P CH 3OH) PABH | = | K0 | (1.1.3) |
| (P CO) PABH⋅( P H 2)2 PABH |
Выражение означает, что в условиях равновесия парциальные давления всех веществ, участвующих в реакции, связаны между собой. Если изменить парциальное давление одного из них, изменятся и парциальные давления всех остальных веществ, но соотношение (1.1.3) между парциальными давлениями веществ, участвующих в реакции, останется строго определенным при данной температуре. Если К - большая величина, то в равновесной смеси продуктов реакции больше, в таком случае говорят, что равновесие сдвинуто в сторону конечных продуктов
Пример 5. Вычисление ∆H0398, ∆S 0398, ∆G0398, K0 398 для реакции
2Н2 + СО → СН3ОН(Г) при температуре Т = 398 К.
По закону Кирхгоффа:
398
∆Н 0398=∆Н 0298+ + ∫ ∆СР dT, (1.1.4)
298
где ∆Н 0 298 = –90,47 кДж/моль (из примера 1).
∆СР = С0 Р,298(СН3ОН) − 2С0 Р,298(Н ) − С0Р,298(СО) (1.1.5)
∆СР= 43,9 – 2 ⋅ 28,83 – 29,15 = –42,91 Дж/(моль⋅К) = –42,91·10-3 кДж/(моль⋅К)
∆Н398 = –90,47 + (–42,91⋅10-3)·(398 – 298) = –94,76 кДж/моль
При повышении температуры на 100 °С, по сравнению со стандартными условиями, тепловой эффект уменьшился. Это связано с тем, что сумма теплоемкостей продуктов реакции меньше суммы теплоемкостей исходных веществ, т.е. изменение средней изобарной теплоемкости (∆СР ) меньше нуля. 398
∆S 398=∆S0298+ ∫ 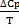 dT (1.1.6)
dT (1.1.6)
298
После интегрирования (1.1.6), при условии ∆СР=const, получаем
∆S398= ∆S0298 + ∆CP 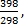
∆S0298 = – 0,219 кДж/(моль⋅K) (из примера 2),
∆S 0398 = –0,219 + (– 42,91⋅10-3) ln 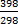 = –0,231 кДж/(моль⋅К),
= –0,231 кДж/(моль⋅К),
∆G 0 398 = ∆H 0398 – 398 ⋅ ∆S0398,
∆G 0 398 = –94,76 – 398(–0,231) = –2,66 кДж/моль.
По уравнению изотермы ∆G 0 398 = – R ⋅ 398 ln K 0 398,
| ln K 03 9 8 = − | ∆G 0 398 | |
| R ⋅ 3 9 8 | ||
| ln K 03 9 8 = − | − 2,66 | = 0,804 |
| 8,31 ⋅10-3⋅ 3 9 8 |
K0 398= е 0,804= 2,235,
K0 298= 2,6 ⋅104 (из примера 4).
Таким образом, с ростом температуры константа равновесия уменьшилась, т.е. выход продуктов реакции уменьшился. Это произошло потому, что реакция экзотермическая, что соответствует принципу Ле-Шателье.
Пример 6. Определение направления процесса в газовой смеси, которая состоит из газообразных Н2, СО и СН3ОН и в которой протекает реакция
2Н2 + СО → СН3ОН(Г) , при Т = 298 К.
Направление процесса определяют по изменению изобарно-изотермического потенциала системы (∆G), который вычисляют по уравнению изотермы химической реакции:
| ∆G = ∆G 0T + RT ln | (P CH 3OH) | (1.1.7) |
| (P CO) ⋅( P H 2) 2 |
где P CH 3OH, P CO, P H2 - относительные парциальные давления газов в исходной смеси.
Например:
1. Если в исходной смеси P CH 3OH = 1,3 атм, P H2= 1,7 атм, PCO = 0,3 атм, то относительные парциальные давления газов
| P CH 3OH = | P CH 3OH | = | 1,3 атм | = 1,3 |
| P0 | 1 атм |
P H2=1,7, PCO = 0,3, тогда при Т = 298 К
| ∆G =∆G0 298+ R⋅298⋅ln | 1,3 | = ( -25,21+ 8,31⋅ 10-3298⋅ln | 1,3 | ) = –24,21кДж/моль. |
| 1,72⋅0,3 | 1,72⋅0,3 |
∆G < 0, следовательно, в этом случае процесс пойдет в прямом направлении: из Н2 и СО будет образовываться СН3ОН.
2.Если в исходной смеси P CH 3OH = 10,3 атм, P H2= 0,007 атм, PCO = 0,003 атм
| (P CH 3OH = | P CH 3OH | = | 10,3 атм | = 10,3, P H2= 0,007, PCO = 0,003), |
| P0 | 1 атм |
то при Т = 298 К
| ∆G =∆G0 298+ R⋅298⋅ln | 10,3 | = ( -25,21+ 8,31⋅ 10-3⋅298⋅ln | 10,3 | ) = 19,53кДж/моль |
| 0,0072⋅0,003 | 0,0072⋅0,003 |
∆G > 0, следовательно, в такой смеси процесс в прямом направлении неосуществим, но возможен в обратном направлении: СН3ОН будет разлагаться на Н2 и СО.
3.Если в исходной смеси P CH 3OH = 9,81 атм, P H2= 0,07 атм, PCO = 0,077 атм, то при Т = 298 К
| ∆G =∆G0 298+ R⋅298⋅ln | 9,81 | ) кДж/моль =0 |
| 0,072⋅0,077 |
∆G = 0, следовательно, такая смесь находится в равновесии.
Пример 7. Определение константы равновесия при заданной температуре по уравнению изобары химической реакции. Константу равновесия химической реакции при заданной температуре Т3 = К0 Т3 можно определить по уравнению изобары химической реакции:
lnK 0= −∆H / RT +const, (1.1.8)
где ∆Н - тепловой эффект реакции в заданном интервале температур. Отсюда легко получить выражение
ln (K0Т2/ K0Т2)=−∆H/ R⋅ (1/ T 1 – 1/ T2) (1.1.9)
позволяющее произвести соответствующие расчеты.
Например, константа равновесия реакции 2Н2 + СО → СН3ОН при Т1 = 500 К равна К0500 = 4,57⋅10-3 , а при Т2 = 540 К равна К0540 = 8,02⋅10-4 . Чтобы определить константу равновесия при Т3 = 520 К, воспользуемся соотношением (1.1.9) и рассчитаем сначала ∆Н, а потом К0520.
ln (8,02⋅10-4 /4,57⋅10-3 )=−∆H/ 8,31⋅10-3 (1/ 500 – 1/ 540)
∆Н = - 97,61 кДж/моль
ln (K0 520 /Κ0500) = ln4,57⋅10 -3 − 97, 61/ 8,31⋅10-3(1/ 500 -1/520)
ln K0 520 = -6,29; K0 520 = 1,85⋅10-3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|