
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа ЛКТ-10. Газовые законы. Приборы и принадлежности. Задание 1. Определение универсальной газовой постоянной. Порядок выполнения работы
Лабораторная работа ЛКТ-10
Газовые законы
Цель работы — определение универсальной газовой постоянной, изучение и применение изотермического процесса.
Приборы и принадлежности
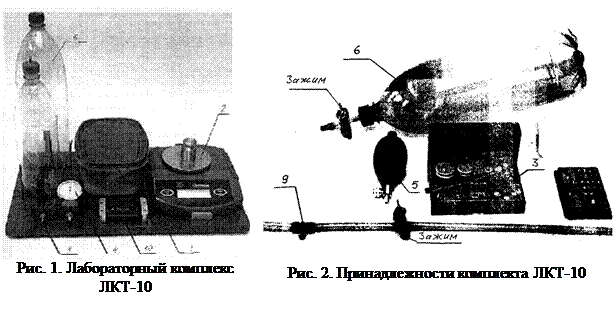
В работе используется лабораторный комплекс ЛКТ‑10 (рис. 1), основные элементы которого смонтированы на плите-основании.
Комплект принадлежностей показан на рис. 2. Баллон объёмом 2 л используется для взвешивания воздуха, баллоны объёмами 1 и 1,5 л — для изучения изотермического процесса, тройник с шлангами и зажимом — для построения различных пневматических схем.
 |
Задание 1. Определение универсальной газовой постоянной
Порядок выполнения работы
1. Определить на весах массу m1 баллона со шлангом и зажимом объемом V = 2 л, внутри которого находится воздух при атмосферном давлении P1.
2. Подключить баллон с помощью тройника к манометру и к груше-помпе. Накачать в баллон воздух до давления Р2 и закрыть зажим на шланге. (Учтите, что манометр показывает давление ΔР = Р2 – Р1). Определить новую массу баллона m2.
3. Из уравнения состояния газа
PV = (m/M)RT, (1)
где М = 29 г/моль — молярная масса воздуха, находится газовая постоянная
R = MV DР / [T(m2 – m1)]. (2)
4. Экспериментальные результаты запишите в таблицу отчета.
Отчет
| ΔР (показание манометра), мм Нg (кПа) | m1, г | m2, г | Т, °С (К) | V, л | R, Дж / (моль∙К) |
Задание 2. Изучение и применение изотермического процесса.
Проверка закона Бойля-Мариотта.
Измеряя давление при изотермическом перетекании газа из сосуда с известным объемом в сосуд с неизвестным объемом, можно определить неизвестный объем. Если сосуд заполнен сыпучим материалом (зерно, грунт и др.), опыт позволяет измерить объем пустот между частицами материала и определить «чистый» объем материала.
Если сосуд объемом V1, в котором находится газ под давлением P1, соединить с сосудом объемом V2 с газом под давлением Р2, то, при одинаковой и постоянной температуре сосудов, установившееся в них давление равно
Р = (P1 V1 + P2 V2) / (V1 + V2), (3)
Это соотношение верно как для полного давления, так и для измеряемого в опыте превышения давления над атмосферным.
Подключите помпу через шланг с зажимом к тройнику, соединенному с манометром и с баллоном объема V1 (2 л). Накачайте в баллон воздух до давления 200–300 мм рт. ст. Затяните зажим и отсоедините помпу. Вместо помпы присоедините баллон объемом V2 (1 л), в котором находится воздух при атмосферном давлении Р2 и комнатной температуре. Баллоны должны быть установлены в держатели на плите-основании. Для того, чтобы температура в баллонах равнялась комнатной температуре, старайтесь долго не держать баллоны в руках и берите их за горлышко. Подождите 1–2 минуты для установления комнатной температуры воздуха в баллонах. Зарегистрируйте давление P1 в баллоне V1. Откройте на шланге зажим, соединяющий пневмосистему с объемом V2. Опять подождите 1–2 минуты для установления комнатной температуры в баллонах и зарегистрируйте давление Р. Проверьте соотношение (3). Расчеты можно проводить в миллиметрах ртутного столба и в литрах. В качестве измеряемых величин используем превышения давлений над атмосферным давлением (Р ® DР,
Р1 ® DР1, Р2 ® DР2 = 0). Эти превышения давлений непосредственно измеряет манометр.
Ртеор (или DРтеор) определяется согласно формуле (3).
| V1, л | DP2, мм рт. ст. | ||
| V2, л | DРэкспер, мм рт. ст. | ||
| DP1, мм рт. ст. | DРтеор, мм рт. ст. (формула (3)) |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|