
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЗАКОНИ ІДЕАЛЬНОГО ГАЗУ. Закон Бойля-Маріотта: ізотермічний процес Т = const. Закон Гей-Люссака: ізобарний процес р = const
| ЗАКОНИ ІДЕАЛЬНОГО ГАЗУ |
Рівняння стану ідеального газу: 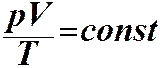
|
Закон Бойля-Маріотта: ізотермічний процес Т = const
 р ізотерма р ізотерма
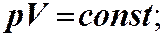  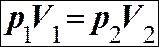 Т2 >Т1
Т2
При ізотермічному процесі тискp Т1
є обернено пропорційним об’ємуV 0 V Т2 >Т1
Т2
При ізотермічному процесі тискp Т1
є обернено пропорційним об’ємуV 0 V
|
Закон Гей-Люссака: ізобарний процес р = const
 p p
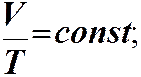   р2 ізобара
р1 р2 > р1
При ізобарному процесі об’єм V 0 V
є прямо пропорційним температурі Т р2 ізобара
р1 р2 > р1
При ізобарному процесі об’єм V 0 V
є прямо пропорційним температурі Т
|
 Закон Шарля: ізохорний процес V = const
р ізохора
Закон Шарля: ізохорний процес V = const
р ізохора
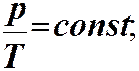  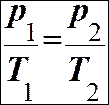 V 2 > V 1
При ізохорному процесі тиск p 0
є прямо пропорційним температурі Т V1 V2 V V 2 > V 1
При ізохорному процесі тиск p 0
є прямо пропорційним температурі Т V1 V2 V
|
| ЗАКОНИ ІДЕАЛЬНОГО ГАЗУ |
Рівняння стану ідеального газу: 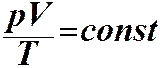
|
Закон Бойля-Маріотта: ізотермічний процес Т = const
 р ізотерма р ізотерма
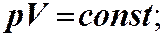   Т2 >Т1
Т2
При ізотермічному процесі тиск p Т1
є обернено пропорційним об’єму V 0 V Т2 >Т1
Т2
При ізотермічному процесі тиск p Т1
є обернено пропорційним об’єму V 0 V
|
Закон Гей-Люссака: ізобарний процес р = const
 p ізобара p ізобара
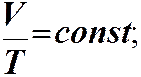  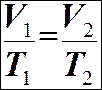 р2 р2 > р1
р1
При ізобарному процесі об’єм V
є прямо пропорційним температурі Т 0 V р2 р2 > р1
р1
При ізобарному процесі об’єм V
є прямо пропорційним температурі Т 0 V
|
 Закон Шарля: ізохорний процес V = const
р ізохора Закон Шарля: ізохорний процес V = const
р ізохора
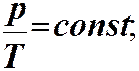  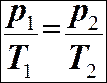 V 2 > V 1
При ізохорному процесі тиск p
є прямо пропорційним температурі Т 0 V1 V2 V V 2 > V 1
При ізохорному процесі тиск p
є прямо пропорційним температурі Т 0 V1 V2 V
|
ЗАКОНИ ІДЕАЛЬНОГО ГАЗУ
Рівняння стану ідеального газу: 
Закон Бойля-Маріотта: ізотермічний процес Т = const
 p
p
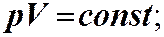

 ізотерма Т1 >Т2
ізотерма Т1 >Т2
Т1
При ізотермічному процесі Т2
тиск є обернено пропорційним об’єму 0
V
Закон Гей-Люссака: ізобарний процес р = const
 p
p
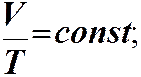

 р2 р2 > р1
р2 р2 > р1
р1 ізобара
При ізобарному процесі об’єм є 0
прямо пропорційним температурі V
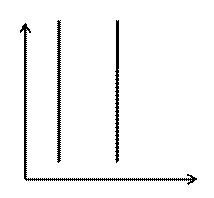 Закон Шарля: ізохорний процес V = const
Закон Шарля: ізохорний процес V = const
p
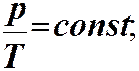

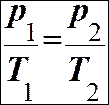 V 2 > V 1
V 2 > V 1
При ізохорному процесі тиск p 0
є прямо пропорційним температурі Т V1 V2 V
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|