
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
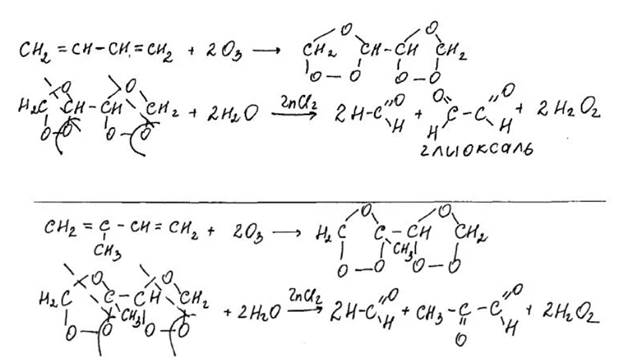
Озонолиз алкадиенов.
Диеновые УВ. Алкадиены. 
Строение молекулы дивинила:
СН2=СН-СН=СН2
Электронная конфигурация атома углерода в нормальном состоянии 2s22р2. Но так как атом углерода образует 4 связи, то у него должно быть 4 неспаренных электрона. Поэтому он переходит в возбужденное состояние за счет распаривания электронов:
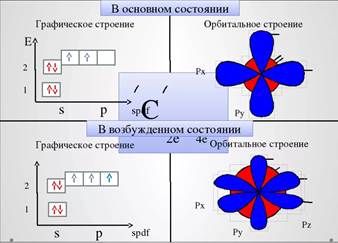
Эти 4 неспаренных электрона находятся на разного вида орбиталях. Так как атом углерода образует 3 сигма связи, то на их образование идет 3 неспаренных электрона, которые находятся на разного вида орбиталях, поэтому происходит их гибридизация- выравнивание орбиталей по форме и энергии. В гибридизацию вступает одна s и две р- орбитали. Образуются три новых гибридных орбитали, которые располагаются под углом 1200
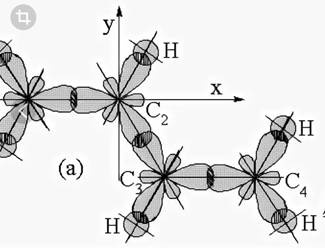
У каждого атома углерода осталось по одной негибридной р-орбитали.
p - Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим.
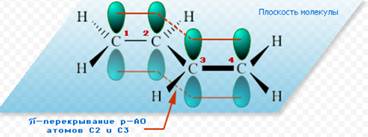
Отсюда видно, что связь между вторым и третьим атомами углерода не является простой σ - связью, а обладает некоторой плотностью p - электронов, т.е. слабым характером двойной связи. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация p - электронов, т.е. равномерное распределение p - электронной плотности по всей молекуле с образованием единого p - электронного облака. Взаимодействие двух или нескольких соседних p - связей с образованием единого p - электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения. Таким образом, молекула бутадиена - характеризуется системой сопряженных двойных связей.
В сопряженной системе π-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом:
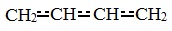
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
ВЫВОД:
· sp2 гибридизация
· плоское-тригональное строение
· угол между гибридными орбиталями = 120 °


4.Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи:
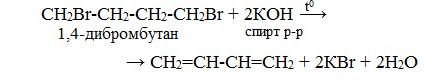


Озонолиз алкадиенов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|