
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Цель работы.. Реактивы и оборудование.. Характеристика метода.. Ход работы.. Техника безопасности.
1. Цель работы.
1.1. Освоить определение Fe2+ в соли Мора методом перманганатометрии.
1.2. Расчёты в методе.
2. Реактивы и оборудование.
1. Мерная колба 250 мл. 5. Промывалки.
2. Колба Эрленмейера. 6. Раствор 2н H2SO4.
3. Бюретка 50 мл. 7. Раствор KMnO4.
4. Пипетки Мора. 8. Раствор соли Мора.
3. Характеристика метода.
Метод перманганатометрии имеет важное применение в объемном определении Fe2+. Сущность этого определения заключается в том, что соли железа (II), титруют раствором KMnO4, где Fe2+окисляется в Fe3+.
Отсчитав затраченный объем KMnO4 и зная его нормальность легко рассчитать количество Fe в исследуемом растворе.
4. Ход работы.
4.1. Титрование:
Получить в мерную колбу раствор соли Мора, разбавить его дистиллированной водой до метки, перемешать. Приступить к титрованию на холоду, а именно, отмерить пипеткой 20 мл р-ра соли Мора, подкислить 10 мл р-ра 2 н H2SO4, после чего из бюретки прибавить титрованный раствор KMnO4 до появления бледно-розовой окраски.
Точное титрование повторить 2-3 раза.
4.2. Вычисление:
По затраченному объёму KMnO4 и его N, рассчитать нормальность соли Мора. По найденной нормальности обычным способом вычислить Т и количество граммов железа в 250 мл. контрольного раствора.
– эквивалентная масса железа равна 55,86 г/моль.
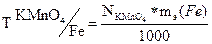
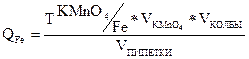
5. Техника безопасности.
5.1. При работе соблюдать правила работы с сильными окислителями (KMnO4).
5.2. Бурые пятна с кожи рук, одежды удаляются раствором щавелевой кислоты.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|