
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Цель работы. Реактивы и оборудование. Ход работы
1. Цель работы
1.1 Освоить метод пермангонатометрии.
1.2 Освоить методику приготовления титрованных растворов по точной навеске.
2. Реактивы и оборудование
2.1 Перманганат калия (сухой).
2.2 Щавелевокислый натрий или щавелевая кислота.
2.3 Серная кислота 2 н р-р.
2.4 Дистилированная вода.
2.5 Хромовая смесь.
2.6 Бюретки со стеклянным краном.
2.7 Пипетка Мора.
2.8 Бюкс.
2.9 Коническая колба емкостью 250-300 мл.
2.10 Штатив с лапкой и соединительной муфтой.
2.11 Мерная колба на 200-250 мл.
2.12 Воронка.
2.13 Промывалка.
2.14 Химический стакан на 50 мл.
2.15 Склянки из темного стекла в 1000 мл. с пробками.
2.16 Пипетка на 100 мл.
3. Ход работы
3.1 Приготовление раствора KМnO4.
Так как даже 1 капля 0,01 н раствора KМnO4 окрашивает 50 мл. жидкости в розовый цвет, по этому удобно применять 0,02 н раствор. Поскольку титрование будет проводиться в кислой среде, необходимо рассчитать г-экв KМnO4.
Для получения 300 мл. 0,02 н раствора KМnO4 нужно отвесить 31,61 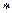 0,02=0,63*0,3=0,19 г. Так как KМnO4 химически не чист и растворе он будет вступать в реакцию с органическими примесями воды, поэтому на технических весах отвешивают 0,21 г. KМnO4. Навеску перенести в стакан, налить туда горячей воды и слить с кристаллов раствор KМnO4 в склянку емкостью 1 л. Добавить в стакан еще горячей воды и слить. Так до полного растворения кристаллов.
0,02=0,63*0,3=0,19 г. Так как KМnO4 химически не чист и растворе он будет вступать в реакцию с органическими примесями воды, поэтому на технических весах отвешивают 0,21 г. KМnO4. Навеску перенести в стакан, налить туда горячей воды и слить с кристаллов раствор KМnO4 в склянку емкостью 1 л. Добавить в стакан еще горячей воды и слить. Так до полного растворения кристаллов.
Добавить в склянку воды приблизительно до 300 мл., перемешать и поставить закрытым в темное место на 7-10 дней. За это время титр раствора KМnO4 установится и будет постоянным. После чего установить титр KМnO4 по оксалату натрия.
3.2 Приготовление титрованного рабочего раствора Na2 C2O4.
При титровании KМnO4 щавелевокислым натрием протекает реакция:
Na2 C2O4 + KMnO4 + H2SO4 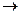 CO2+ MnSO4 + H2O + K2SO4
CO2+ MnSO4 + H2O + K2SO4
Необходимо рассчитать навеску Na2 C2O4 для приготовления 0,02 н раствора. Грамм-эквивалент оксалата натрия равен: mэ(Na2 C2O4)= 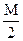 =67 г/моль.
=67 г/моль.
Для приготовления 250мл. 0,02 н раствора надо взять 67 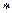 0,25=0,335 г. Na2 C2O4. Отвесить точную массу на аналитических весах, количественно перенести навеску в мерную колбу емкостью 250 мл. Растворить оксалат натрия в небольшом количестве воды.
0,25=0,335 г. Na2 C2O4. Отвесить точную массу на аналитических весах, количественно перенести навеску в мерную колбу емкостью 250 мл. Растворить оксалат натрия в небольшом количестве воды.
Довести объем раствора в колбе до метки и тщательно перемешать. Рассчитать титр и нормальность раствора Na2 C2O4 и записать в таблицу. Расчет вести по формуле:
T= 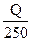 ; N=Т
; N=Т 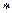 1000/mэ,
1000/mэ,
 3.3 Титрование.
3.3 Титрование.
Установить титр и нормальность раствора KMnO4. Для этого в чисто вымытую коническую колбу пипеткой, предварительно ополоснув ее раствором оксалата натрия, перенести 25 мл раствора Na2 C2O4. Туда же прибавить 10 мл 2 н раствора серной кислоты. Нагревать смесь в колбе до 70-80о С (кипятить нельзя). Бюретку ополоснуть раствором KMnO4 и заполнить ее этим же раствором до нулевого деления. Если нижний край мениска плохо виден, установить уровень и вести отсчет по верхнему краю мениска. Раствор KMnO4 из бюретки приливают по каплям к горячему раствору оксалата натрия, перемешивают содержимое в колбе. Малиновая окраска раствора исчезает. Нужно уловить момент, когда одна капля раствора KMnO4 окрасит раствор в колбе в слаборозовый цвет, не исчезающий 1-2 мин. Повторить титрование 2-3 раза до сходящих результатов. Данные записать в таблицу.
3.4 Расчет.
По затраченным объемам при титровании оксалата натрия и KMnO4 и концентрации оксалата натрия рассчитывают нормальность и титр KMnO4 по формулам:
3) N (KMnO4) * V (KMnO4) =N (Na2 C2O4) * V(Na2 C2O4) ;
4) T(KMnO4) =N (KMnO4) 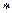 mэ(KMnO4) / 1000.
mэ(KMnO4) / 1000.
| Номер бюкса | Навеска Na2 C2O4 г | Титр Na2 C2O4 г/мл | N Na2 C2O4 | V KMnO4 мл | N KMnO4 н | Титр KMnO4 г/мл |
|
|
|
|
| |||
| Среднее значение | ||||||
1) T(Na2C2O4) = 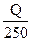 = 0,000000 г/мл;
= 0,000000 г/мл;
2) N(Na2C2O4) =Т(Na2C2O4) 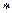 1000/mэ(Na2C2O4) = 0,0000 н,
1000/mэ(Na2C2O4) = 0,0000 н,
3)
V1 = мл, N1 (KMnO4) =N (Na2 C2O4) * V(Na2 C2O4) / V (KMnO4) = 0,0000 н ;
V2 = мл, N2 (KMnO4) =N (Na2 C2O4) * V(Na2 C2O4) / V (KMnO4) = 0,0000 н ;
V3 = мл, N3 (KMnO4) =N (Na2 C2O4) * V(Na2 C2O4) / V (KMnO4) = 0,0000 н ;
4)
T1(KMnO4) =N (KMnO4) 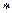 mэ(KMnO4) / 1000 = 0,0000000 г/мл.
mэ(KMnO4) / 1000 = 0,0000000 г/мл.
T2(KMnO4) =N (KMnO4) 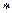 mэ(KMnO4) / 1000 = 0,0000000 г/мл.
mэ(KMnO4) / 1000 = 0,0000000 г/мл.
T3(KMnO4) =N (KMnO4) 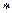 mэ(KMnO4) / 1000 = 0,0000000 г/мл.
mэ(KMnO4) / 1000 = 0,0000000 г/мл.
Tср(KMnO4) =N (KMnO4) 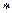 mэ(KMnO4) / 1000 = 0,0000000 г/мл.
mэ(KMnO4) / 1000 = 0,0000000 г/мл.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|