
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
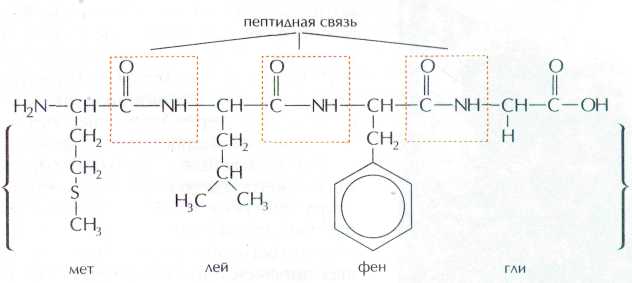
Химические свойства белков.
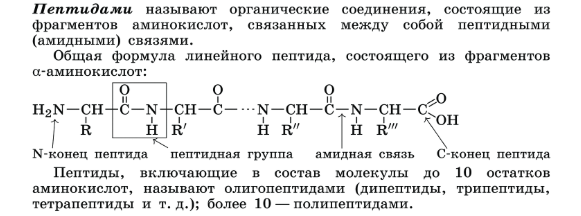


 (Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX в.). Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке.В организме человека свыше 10 000 различных белков, и все они построены из одних и тех же 20 α-аминокислот, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 10. Потенциально возможное число белков с различной первичной структурой практически не ограничено.
(Полипептидную теорию строения белков предложил немецкий химик Э. Фишер в начале XX в.). Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке.В организме человека свыше 10 000 различных белков, и все они построены из одних и тех же 20 α-аминокислот, которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 10. Потенциально возможное число белков с различной первичной структурой практически не ограничено.
Один из первых белков, первичная структура которого была установлена в 1954 г., — гормон инсулин(регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой — 30).
Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Многие генетические болезни - результат нарушения в аминокислотной последовательности белков. Информация о первичной структуре нормального и мутантного белка может быть полезна для диагностики и прогнозирования развития заболевания.
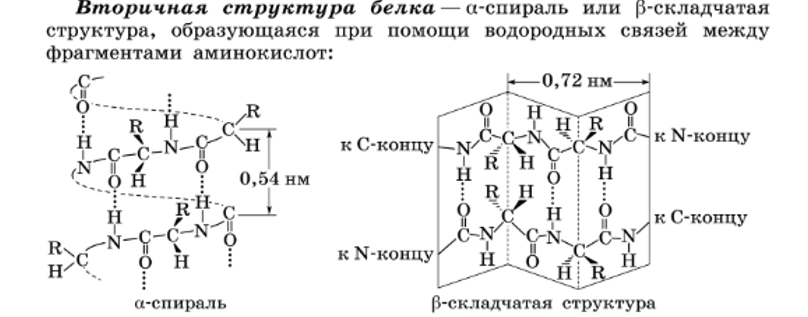
Вторичная структура белков возникает в результате образования водородных связей между группами —СООН и —NH2 -разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Вторичная структура белка(для большинства белков) — это α-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами: —СО— и —NН—
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.

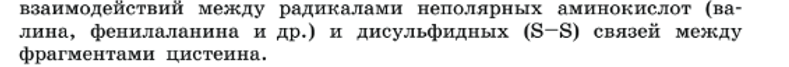 У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Эта структура поддерживается за счет водородных, дисульфидных, ионных и других связей.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Эта структура поддерживается за счет водородных, дисульфидных, ионных и других связей.
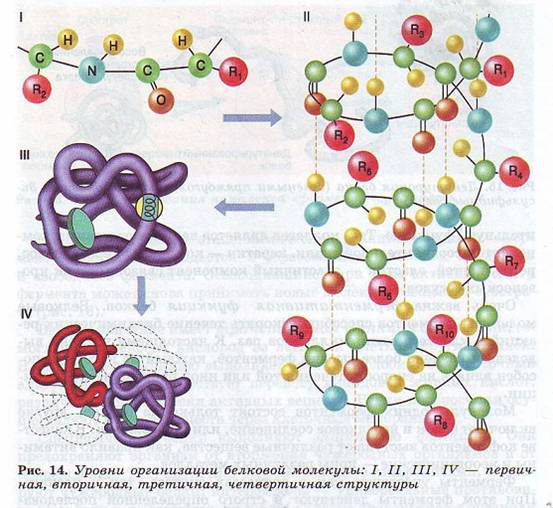
Многие (но не все) белки имеют четвертичную структуру, которая образуется, когда несколько молекул белка, имеющих третичную структуру, взаимодействуют друг с другом через радикалы аминокислот. В результате формируется молекула в виде шара (глобулярные белки) или нити (фибриллярные белки).
По структурным признакам общепринято деление белков на две большие группы:
-простые белки (протеины) структура которых представлена только полипептидной цепью. Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты (альбумин-белок куриного яйца)
-сложные белки (протеиды), которые содержат небелковый компонент. Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. Сложные могут включать ионы металла , остатки фосфорной кислоты , остатки углеводов. Протеиды подразделяются на несколько групп, важнейшими из которых являются:
1) гликопротеиды (сложное соединение белка и углевода);
2) липопротеиды (комплекс молекул белка и жиров (липидов);
3) нуклеопротеиды (комплекс белковых молекул и молекул нуклеиновых кислот).
По форме молекулы различают две группы белков:
1. Глобулярные белки — молекула белка имеет шарообразную форму (форму глобулы), например молекулы яичного альбумина; такие белки или растворимы в воде, или способны к образованию коллоидных растворов.
2. Фибриллярные белки — молекулы этих веществ имеют форму нитей (фибрилл), например, миозин мышц, фиброин шелка. Фибриллярные белки нерастворимы в воде, они образуют структуры, реализующие сократительную, механическую, формообразующую и защитную функции, а также способность организма передвигаться в пространстве.
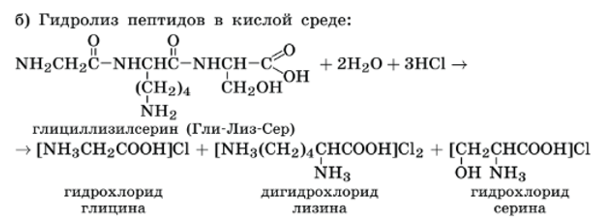
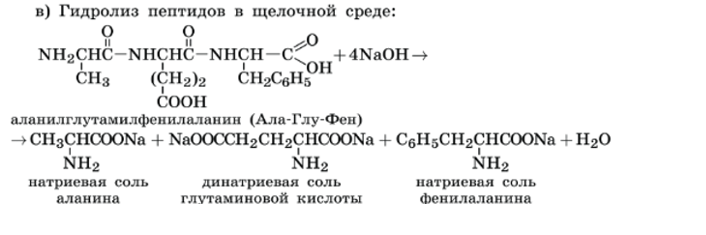
Химические свойства белков.


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|