
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Составить соотношение молярных масс реагирующих металлов с учётом стехиометрических коэффициентов, в данном случае 1:1.
3. Составить соотношение молярных масс реагирующих металлов с учётом стехиометрических коэффициентов, в данном случае 1:1.
х:у=64:201
4. Составить систему уравнений и решить её;
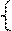 50-х+у=52,74
50-х+у=52,74
х:у=64:201
Поскольку по условию задачи Необходимо найти массу меди, то из второго уравнения нужно выразить у через х и решить систему методом подстановки.
у=3,14х
отсюда подставив в первое уравнение получаем алгебраическое выражение
50-х+3,14х=52,74
2,14х=2, 74
х=1, 28 (г)
Вариант 2: через нахождение количества вещества
2. Найти количество вещества меди в пластинке.
ν(Сu) = m(Cu)/M(Cu) = 50,00 г/ 64 г/моль = 0,78 моль
3. Количество вещества прореагировавшей меди неизвестно, поэтому обозначим как х.
4. Выразить массу прореагировавшей меди через произведение:
m(Cu)прореаг = ν(Сu)·M(Cu) = х моль х 64 г/моль = 64х г
5. Найти массу образовавшейся ртути
m(Hg) = ν(Hg)·M(Hg) = х моль х 201 г/моль = 201х г
6. Записать уравнение материального баланса для пластинки:
mпластинки исх. – m(Cu)прореаг. + m(Hg) = mпластинки конечн.
7. На основании материального баланса составить уравнение
50 – 64х + 201х = 52,74 137х = 2,74 х = 0,02 моль
8. Найти массу прореагировавшей меди
m(Cu)прореаг.= ν(Сu)·M(Cu) = 0,02 моль х 64 г/моль = 1,28 г
Ответ: масса растворившейся меди равна 1,28 г
РЕШАЕМ САМИ
Задача 1. Железную пластинку массой 20,4 г поместили в раствор сульфата меди (II), масса раствора 100 г. Через некоторое время масса пластинки оказалась равной 22,0 г. Вычислите массу меди, выделившейся на пластинке, и массовую долю сульфата железа(II) в растворе после реакции.
Ответ: m(Cu) = 12,8 г, ω(FeSO4) = 30,8%.
Задача 2. Железную пластинку поместили в 150 мл раствора сульфата меди с ω1(CuSO4) = 16% (плотность раствора 1,18 г/мл). В результате реакции масса пластинки увеличилась на 0,8 г. Вычислите массовую долю CuSO4 в растворе после реакции.
Ответ: ω2(CuSO4) = 7%
Задача 3.После погружения железной пластинки в 200 мл раствора с массовой долей CuSO4 14,5% (плотность раствора 1,16 г/мл) её масса в результате реакции увеличилась на 0,4 г. Определите массовые доли веществ в растворе после реакции.
Ответ: ω(FeSO4) = 3,28%, ω2(CuSO4) = 11,07%
Задача 4. После погружения железной пластинки в 200 мл раствора с массовой долей CuSO4 14,5% (плотность раствора 1,16 г/мл) её масса в результате реакции увеличилась на 0,4 г. Определите массовые доли веществ в растворе после реакции.
Ответ: m2 (пласт.) = 5,2 г; ω2(CuSO4) = 6,27%, ω(FeSO4) = 5,96%
Задача 5. Железную пластинку массой 5 г поместили в раствор сульфата меди с ω1(CuSO4) = 12,5%, масса раствора 64 г. Через некоторое время количество сульфата меди в растворе уменьшилось вдвое. Какой стала масса пластинки? Вычислите массовые доли веществ в полученном растворе.
Ответ: m2 (пласт.) = 10,64 г, ω(FeSO4) = 0,081 (8,1%)
Задача 6. Железную пластинку массой 10 г погрузили в раствор с ω1(CuSO4) = 16%, масса раствора 150 г. Определите, какой стала масса пластинки после реакции, в результате которой содержание сульфата меди в растворе уменьшилось до ω2(CuSO4) = 7,5%. Какова массовая доля FeSO4 в полученном растворе?
Ответ:
Задача 7. Цинковые опилки массой 13 г поместили в раствор сульфата никеля (II) массой 280 г. Через некоторое время металлические опилки отфильтровали, высушили и взвесили. Их масса оказалась равной 11,8 г. Определите массовую долю сульфата цинка в фильтрате.
Ответ: ω(ZnSO4) = 11,45%
Задача 8. Железную пластинку поместили в раствор сульфата меди (II) массой 150 г. Через некоторое время масса пластинки увеличилась на 0,6 г, а массовая доля CuSO4 в образовавшемся растворе (ω2) стала равной 5%. Определите массовую долю CuSO4 в исходном растворе (ω1).
Ответ: ω1(CuSO4) = 13%
Задача 9. Цинковые опилки массой 15 г поместили в 250 мл 1,2 M раствора нитрата меди (II). Через некоторое время концентрация ионов Cu2+ в растворе уменьшилась в 2 раза. Определите молярную концентрацию ионов Zn2+ в растворе после реакции. Какой стала масса металлических опилок?
Ответ: c(Zn2+) = 0,6 моль/л; m(мет.) = 14,85 г.
Задача 10. Медную пластинку на некоторое время погрузили в 125 мл 1,2 M раствора нитрата серебра. В результате концентрация ионов Cu2+ в растворе оказалась равной 0,1 моль/л. Какой стала концентрация нитрата серебра? Какая масса серебра выделилась на пластинке, и как изменилась масса пластинки? Изменением объема раствора можно пренебречь.
Ответ: c2 (AgNO3) = 1,0 моль/л; m(Ag) = 2,7 г; Δm(пласт.) = 1,9 г.
Задача 11. Свинцовую пластинку выдерживали некоторое время в 180 г 25 %-ного раствора нитрата меди (II). В результате масса пластинки уменьшилась на 18,6 г. Определите массу меди, выделившейся на пластинке и массовые доли веществ в образовавшемся растворе.
Ответ: m(Cu) = 8,32 г, ω1 = 10,4%, ω2 = 21,7 %
Задача 12. Медную пластинку массой 13,2 г поместили в раствор нитрата железа(III) массой 300 г с массовой долей соли 0,112. После некоторого выдерживания пластинки в растворе ее вынули. В результате массовая доля нитрата железа(III) оказалась равной массовой доле соли меди(II). Определите массу пластинки после окончания реакции (когда ее вынули из раствора).
Ответ: m2 (пласт.) = 10г
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|