
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ВОПРОС 3. Электроотрицательность, валентность и степень окисления химических элементов
ВОПРОС 3. Электроотрицательность, валентность и степень окисления химических элементов
План занятия «электроотрицательность, степень окисления и валентность химических элементов»:
1. Понятие электроотрицательность. Изменение значений ЭО элементов.
2. Понятие валентность. Определение валентности химических элементов.
3. Понятие степень окисления. Определение степени окисления химических элементов.
1. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ.
Это свойство атома в молекуле смещать к себе общие электронные пары, то есть способность атомов оттягивать к себе электроны других атомов.
В группах сверху вниз значение электроотрицательности уменьшается, в периодах слева направо – увеличивается.
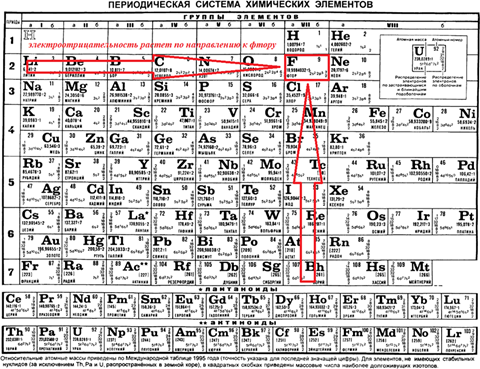 Самый электроотрицательный элемент – фтор. Поэтому, когда движемся к фтору, то электроотрицательность всегда увеличивается!
Самый электроотрицательный элемент – фтор. Поэтому, когда движемся к фтору, то электроотрицательность всегда увеличивается!
2. ВАЛЕНТНОСТЬ.
Это способность атомов химических элементов образовывать определённое число химических связей.
ВЫСШАЯ валентность элемента равна номеру группы в ПСХЭ!!!
НИЗШАЯ валентность элемента равна 8 - № группы элемента
| Элементы с постоянной валентностью | Элементы с переменной валентностью |
| Валентность I характерна для H F Li Na K Rb Cs Fr Валентность II характерна для O Be Ca Mg Sr Ba Ra Zn Валентность III характерна для Al | В разных соединениях могут иметь различные значения валентности. |
Наиболее характерные значения валентности некоторых элементов
| Элементы | Наиболее характерные валентности |
| Сl, Вr, I | I, III, V, VII |
| S | II, IV, VI |
| С, Si, Sn, Рb | II, IV |
| P | III, V |
| Аg, Аu | I, III |
| Cu | I, II |
| Fe | II, III |
| Cr | II, III, VI |
| Mn | II, III, IV, VI, VII |
| N | I II III IV (но высшая степень окисления = +5) |
Для определения валентности таких элементов в каком-либо данном соединении можно использовать правило валентности.
Согласно этому правилу, в большинстве бинарных соединений типа АmВn произведение валентности элемента А (х) на число его атомов (m) равно произведению валентности элемента В (у) на число его атомов (n):
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|