
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Официальная шпаргалка по физической химии (термодинамика, кинетика, электрохимия)»
«Официальная шпаргалка по физической химии (термодинамика, кинетика, электрохимия)»
| Первый закон т/д | 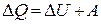
| Q – теплота, U – внутренняя энергия, А – работа |
| для процесса при Т=const | 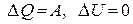 , ,
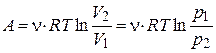
| ν – количество вещества, R – универсальная газовая постоянная (8,314 Дж/моль∙К), Т – температура, V – объем, p – давление |
| для процесса при V=const | 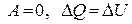 , ,
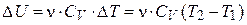
| CV – изохорная теплоемкость |
| для процесса при P=const | 
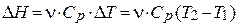
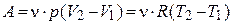
| Н – энтальпия, Ср – изобарная теплоемкость |
| Закон Гесса: следствия | 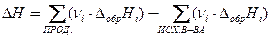 , ,
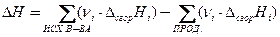
| νi – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции, ΔНобр,i – энтальпия образования вещества, ΔНсгор,i – энтальпия сгорания вещества, ΔН – тепловой эффект реакции |
| Тепловая машина | 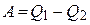 , ,
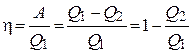 , ,
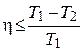
| А – работа тепловой машины, Q1 – тепло, полученное от нагревателя, Q2 – тепло, переданное холодильнику, η – КПД тепловой машины, Т1 – температура нагревателя, Т2 – температура холодильника. |
| Второй закон т/д | 
| S – энтропия |
| Энтропия в различных процессах | для фазового перехода 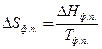 , ,
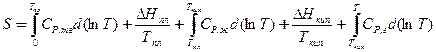 ,
для хим. реакции ,
для хим. реакции 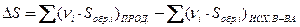
| ΔНф.п. – энтальпия фазового перехода, Тф.п. – температура фазового перехода, Sобр – энтропия образования вещества |
| Энергия Гиббса (для P,T=const) | G=H–TS, A=–ΔG | |
| Энергия Гельмгольца (для V,T=const) | F=U–TS, A=–ΔF | |
| Уравнение Гиббса-Гельмгольца | 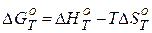
| ΔG – изменение энергии Гиббса в ходе реакции |
| Константа равновесия | Если реакция имеет вид m A + n B ↔ x C + y D, то
 , ,
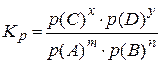 (если все вещества – газы) (если все вещества – газы)
| A, B, C, D – вещества, участвующие в реакции, m, n, x, y – стехиометрические коэффициенты, Кс – константа равновесия, выраженная через равновесные молярные концентрации компонентов, Кр – константа равновесия, выраженная через равновесные парциальные давления компонентов. |
| Правило фаз Гиббса | С=К–Ф+2 | С – число степеней свободы равновесной системы, К – число компонентов, Ф – число фаз. |
| Коллигативные свойства растворов | закон Рауля (понижение давления пара) 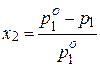 , ,
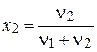 ,
эбуллиоскопия ,
эбуллиоскопия 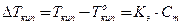 , ,
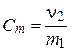 криоскопия
криоскопия 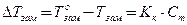 осмос
осмос 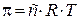 , ,

| х2 – молярная доля растворенного вещества (компонента 2), 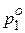 – давление насыщенного пара растворителя (компонента 1), – давление насыщенного пара растворителя (компонента 1), 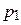 – давление пара растворителя над раствором, ν1 и ν2 – количество вещества растворителя и растворенного вещества, m1 – масса растворителя (в кг), Кэ и Кк – эбуллиоскопическая и криоскопическая постоянные растворителя, Сm – моляльная концентрация растворенного вещества, Ткип и Тзам – температура кипения и температура замерзания раствора, – давление пара растворителя над раствором, ν1 и ν2 – количество вещества растворителя и растворенного вещества, m1 – масса растворителя (в кг), Кэ и Кк – эбуллиоскопическая и криоскопическая постоянные растворителя, Сm – моляльная концентрация растворенного вещества, Ткип и Тзам – температура кипения и температура замерзания раствора, 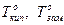 – температура кипения и температура замерзания чистого растворителя, π – осмотическое давление раствора (в атм), с – молярная концентрация раствора, R – универсальная газовая постоянная (в данном случае – 0,082 л∙атм/моль∙К), V – объем раствора – температура кипения и температура замерзания чистого растворителя, π – осмотическое давление раствора (в атм), с – молярная концентрация раствора, R – универсальная газовая постоянная (в данном случае – 0,082 л∙атм/моль∙К), V – объем раствора
|
| Скорость хим. реакции | 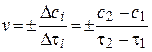
| v – скорость реакции, Δс – изменение концентрации любого из участников реакции, Δτ – время, в течение которого произошло изменение концентрации. Знак «+» перед дробью ставится, если скорость рассчитывается по продуктам реакции, знак «–» – если по исходным веществам |
| Закон действующих масс | для реакции m A + n B → x C + y D
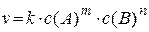
| k – константа скорости реакции |
| Уравнение Вант-Гоффа | 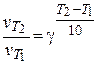
| γ – температурный коэффициент скорости реакции. |
| Уравнение Нернста |  ,
при р=1 атм и Т=298К ,
при р=1 атм и Т=298К 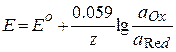 ,
для металлических электродов ,
для металлических электродов 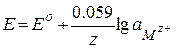
| Е – электродный потенциал, Ео – стандартный электродный потенциал, z – число электронов, участвующих в электродном процессе (полуреакции), F – постоянная Фарадея (96484 Кл/моль), aOx – активность (концентрация) окисленной формы компонента, aRed – активность (концентрация) восстановленной формы компонента, , aMz+ – активность (концентрация) ионов металла |
| Уравнение Менделеева-Клапейрона | 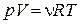
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|