
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Все соединения Cr(+6) проявляют сильные окислительные свойства.
Все соединения Cr(+6) проявляют сильные окислительные свойства.
Оксид CrO3 – темно-красное кристаллическое вещество, гигроскопичен, сильно ядовит.
Многие органические вещества окисляются под его воздействием до СО2 и Н2О. Если стеклянную палочку смочить в CrO3 и поднести к спиртовке, она загорится.
Получают CrO3 по реакции:
K2CrO4 + 2Н2SO4(конц) = 2KHSO4 + 2CrO3 + H2O
С водой оксид CrO3 реагирует с образованием двух кислот H2CrO4 и Н2Cr2O7, известных только в растворе. В водном растворе устанавливается равновесие:
2H2CrO4 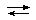 Н2Cr2O7 + H2O
Н2Cr2O7 + H2O
В щелочных растворах более устойчив CrO42–- (желтого цвета) , в интервале рН от 2 до 6 сосуществует в равновесии с Cr2O72– (оранжевого цвета) и HCrO4– ионы:
Cr2O72– + H2O  2HCrO4–
2HCrO4–  CrO42–- + 2Н+
CrO42–- + 2Н+

Хромат калия K2CrO4 – кристаллизуется в виде безводных желто-лимонных кристаллов.
Бихромат калия K2Cr2O7 – из водных растворов кристаллизуется в виде безводных оранжевых пластинок.
Бихромат аммония (NH4)2Cr2O7при нагревании до 200 оС энергично сгорают с образование тонкодисперсной окиси хрома(III).
(NH4)2Сr2O7 = Cr2O3 + 4 H2O + N2
Бихроматы и хроматы являются сильными окислителями
Сr2O72– + 14H+ +6e– = 2Cr3++ 7H2O; (E0= +1,33 В).
CrO42–+ 4H2O +3e– = Cr(OH)3 + 5OН–; (E0= +0,13 В).
Пероксохроматы
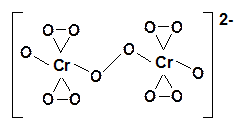
При взаимодействии соединений Сr(VI) с перекисью водорода в зависимости от условий проведения реакции можно получать различные пероксохроматы: красные [CrO8]3– и синие [Cr2O12]2–.
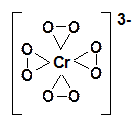
Красный пероксохромат калия K3CrO8 получают при взаимодействии 30% -ной перекиси водорода на сильнощелочной раствор хромата калия.
Синий пероксохромат калия K2Cr2O12 получают при взаимодействии 30% -ной перекиси водорода на раствор бихромата калия, охлажденному до 0oC.
Синяя перекись хрома CrO5 известна в растворах:

В водном растворе при обычной температуре пероксохроматы неустойчивы и разлагаются с выделением кислорода.
Соединения хрома (+3)
Оксид Cr2O3 – наиболее устойчивое соединение Cr(III). Оксид Cr2O3 – зеленый порошок, нерастворимый в воде. Прокаленная окись хрома(III) с большим трудом растворяется в кислотах.
Гидрат окиси хрома Cr(OН)3• nH2Oрастворяется и в растворах кислот и в растворах щелочей:
Cr(OH)3 + 3NaOН=2 Na3[Cr(OH)6]
Cr(OH)3 + 3НCl=CrCl3 + 3H2O
Хромовые квасцы KCr(SO4)2•12H2Oкристаллизуются из смешанного раствора сульфата хрома и сульфата калия, по составу и кристаллической структуре полностью соответствуют алюмокалиевым квасцам KAl(SO4)2•12H2O.
Безводный хлорид хрома CrСl3 – блестящие листочки красно-фиолетового цвета.
Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в комплексных продуктах присоединения аммиака, например [Cr(NH3)6]3+.
Соединения хрома (+2)
В водных растворах соединения Cr(+2) сильные и быстродействующие восстановители.
Водные растворы Cr(II) используют в качестве поглотителей кислорода:
2CrCl2 + 2HCl + 1/2O2 = 2CrCl3 + H2O
Cr + I2 = CrI2
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|