
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Идеальный газ. Основное уравнение МКТ идеального газа. Температура – мера средней кинетической энергии молекул.
Билет №3 (вопрос1)
Идеальный газ. Основное уравнение МКТ идеального газа. Температура – мера средней кинетической энергии молекул.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом.
Состояние идеального газа, удовлетворяет трем условиям:
1) размеры молекул малы по сравнению с расстоянием между ними;
2) молекулы находятся в тепловом движение;
3) движение каждой молекулы подчиняется законом механики.
Разряженный газ при высокой температуре можно считать идеальным.
Идеальный газ оказывает давление, которое объясняется соударением молекул друг с другом и со стенками сосуда.
Давление газа зависит от массы, скорости и количества молекул.
Уравнение, связывающие эти величины, называют уравнением МКТ.
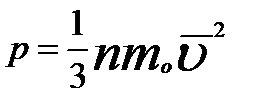 р - давление (Па)
р - давление (Па)
m0- масса молекулы (кГ)
- средняя квадратичная скорость молекул (м/c)
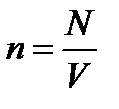 n – концентрация молекул – это число молекул в единице объема
n – концентрация молекул – это число молекул в единице объема 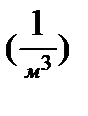
Давление газа численно равно средней кинетической энергией молекул, содержащихся в единице объема. 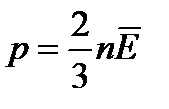
Так как молекулы газа находятся в тепловом движение, то они обладают кинетической энергией. Чем выше температура газа, тем быстрее движутся молекулы, тем больше их кинетическая энергия.
Средняя кинетическая энергия молекул прямо пропорциональна абсолютной температуре.
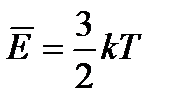 - уравнение Больцмана, где k- постоянная Больцмана.
- уравнение Больцмана, где k- постоянная Больцмана. 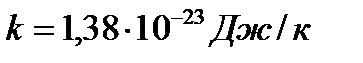
T – абсолютная температура (К – Кельвин)
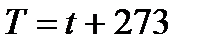
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|