
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решение задач по теме : «Металлы»
Решение задач по теме : «Металлы»
Выход продукта реакции.
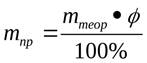
Пример. При разложении 175 г хлората калия KClO3 образовались кислород и хлорид калия. Массовая доля выхода продукта реакции составила 95%. Вычислите практическую массу хлорида калия, полученного при данной реакции.
Решение :
Уравнение реакции:
2KClO3 = 2KCl + 3O2
175 г KClO3 это 175/122 = 1,434 моль.
Образуется 1,434*0,95 = 1,362 моль KCl, то есть 1,362*74.5 = 101,5 г.
*Чему равна масса практическая сульфата бария, который получен при взаимодействии 15г хлорида бария с серной кислотой, если выход продукта составляет 93%
*Какое из следующих соединений содержит больше железа:
FeO, Fe2O3, Fe3O4.
*Выведите формулу соединения, состоящего 88,85% из меди и 11,2% - кислорода.
*Сколько граммов кальция содержится в 250 г карбоната кальция?
* Рассчитайте объем хлора (н.у.) необходимого для полного сгорания 5,6 г железа.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|