
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Угольная кислота и её соли. Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота и её соли
1. Химическая формула-
Структурная формула – все связи ковалентные полярные:
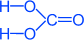
2. Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
H2CO3  CO2
CO2  + H2O
+ H2O
3. Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует в малой степени в две ступени, поэтому изменяет окраску индикатора слабо:
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами(закончите уравнения реакции)
H2CO3 + Ca =
3) с основными оксидами(закончите уравнения реакции)
H2CO3 + BaO =
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O (составьте полное и сокращённое уравнения реакции, помните угольная кислота – слабый электролит, поэтому ее расписывать на ионы нельзя).
5) Очень непрочная кислота – разлагается
H2CO3 ↔CO2 + H2O
4.Соли угольной кислоты – карбонаты и гидрокарбонаты
Средние соли - карбонаты СаСO3, (NH4)2CO3 Большинство из них в воде не растворяются (кроме солей ЩМ и NH4+)
Кислые соли - гидрокарбонаты NaHCO3 , Ca(HCO3)2 - растворяются в воде.
5. Химические свойства солей угольной кислоты:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = (закончите уравнения реакции)
2) Разложение всех гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании (кроме солей ЩМ, искл. Li)
CaCO3 t˚C → CaO+ CO2↑
Li2CO3 t˚C → Li2O+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Напишите два уравнения реакций (см. стр.136 учебника)
6. Качественная реакция на CO32- карбонат – ион - "бурное вскипание" при действии сильной кислоты:
Na2CO3 + 2HCl =
Составьте молекулярное, полное и сокращённое уравнения реакций.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|