
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Соли, их классификация и свойства»
29.04.2020
Пишем все в тетрадь
Тема урока:
«Соли, их классификация и свойства»
Параграф 42.
Повторение . Тема Оксиды. Выполните тест
Тестовая работа.
1 вариант.
1. Сколько оксидов записано в перечнеP2O5, H2SO4, NaOH, Na2CO3, CO2:
1) 1 2) 2 3) 3 4) 4
2. Формулы кислотных оксидов записаны в ряду:
1) Cl2O, Mn2O7, P2O5 3) CaO, MnO, N2O5
2) N2O3, CO2, ZnO 4) SiO2, SO3, Na2O
3. Оба вещества взаимодействуют с оксидом серы (VI):
1) Основный оксид и нерастворимое основание
2) Кислота и соль
3) Основный оксид и щелочь
4) Вода и соль
4. С оксидом лития взаимодействуют вещества, формулы которых:
А. NaCl Б. SO3 В. HCl Г. NaOH Д. CuO
1) А и Б 2) В и Г 3) Б и Д 4) Б и В
5. Установите соответствие между формулой оксида и соответствующей ей кислотой.
ФОРМУЛА ОКСИДА ФОРМУЛА КИСЛОТЫ
А. SO3 1) H2S
Б. Mn2O7 2) H2SO4
В. SO2 3) HMnO4
4) H2MnO4
5) H2SO3
6. Какой из оксидов, формула которого приведена, вступает в реакцию с водой с образованием основания?
1) Al2O3 2) CuO 3) SiO2 4) BaO
Тема урока: «Соли, их классификация и свойства»
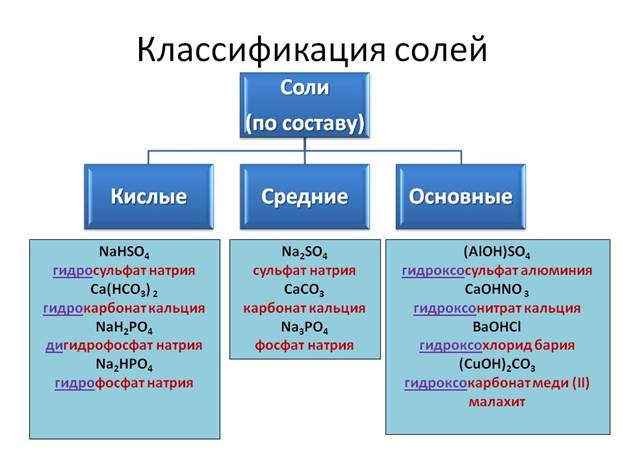
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
1. Раствор соли взаимодействует с более сильной кислотой, если образуется газ или осадок.
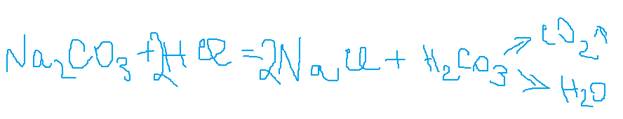
Составьте полное и сокращённое ионное уравнение.
2. Раствор соли взаимодействует с раствором щёлочи, если хотя бы один продукт не растворим или образуется газ.
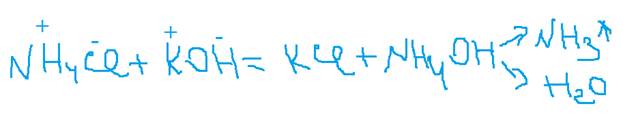
Составьте полное и сокращённое ионное уравнение.
3. Раствор соли взаимодействует с другим раствором соли, если хотя бы один продукт нерастворим.
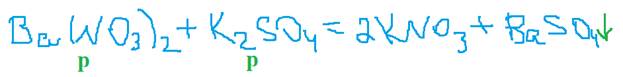
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|