
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Длина ковалентной связи — это расстояние между ядрами связанных атомов.
Важнейшими характеристиками ковалентной связи являются длина, полярность ипрочность. Эти характеристики определяют физические и химические свойства вещества: их температуры плавления и кипения, растворимость, химическую активность.
Длина ковалентной связи — это расстояние между ядрами связанных атомов.
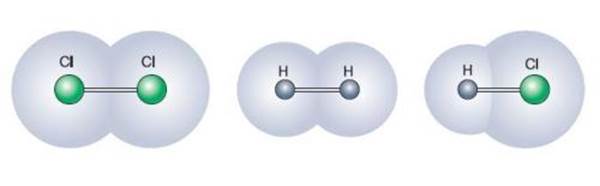
Длина химической связи зависит от радиусов атомов.
Чем больше радиусы атомов, тем длиннее связь между ними.
H−H — 0,074 нм;
F−F — 0,142 нм;
Cl−Cl — 0,198 нм;
Br−Br — 0,228 нм;
I−I — 0,267 нм.
Кратность связи тоже влияет на её длину.
Чем больше общих электронных пар у атомов, тем короче связь.
C−C — 0,154 нм;
C=C — 0,133 нм;
C≡C— 0,120 нм.
Прочность ковалентной связи — устойчивость общей электронной пары к разрыву.
Прочность связи определяет химическую активность вещества: чем меньше прочность связи, тем легче вещество вступает в химические реакции.
Прочность связи зависит от её длины и кратности.
Чем меньше длина связи, тем она прочнее.
Пример:
H−F,H−Cl,H−Br.
В ряду галогеноводородов длина связи растёт, а прочность уменьшается.
Чем больше кратность связи, тем выше её прочность.
Пример:
F−F,N≡N
Молекулы фтора и азота отличаются кратностью связи. Чтобы разделить молекулу азота на атомы, необходимо затратить примерно в семь раз больше энергии, чем для разрыва связи в молекуле фтора.
Полярность ковалентной связи — значения частичных зарядов на связанных атомах.
Полярность ковалентной связи зависит от разности электроотрицательностей этих атомов.
Чем сильнее отличаются атомы по электроотрицательности, тем больше полярность связи.
Пример:
H0,43+→F0,43−,H0,18+→Cl0,18−,H0,12+→Br0,12−.
Полярность связи уменьшается, что согласуется с положением атомов в ряду электроотрицательности.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|