
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Пример выполнения
Фамилия Имя: класс дата
Начало формы
Конец формы
Лабораторная работа «Определение заряда электрона»
Цель работы: научиться определять заряд электрона экспериментальным путем.
Схема измерительной установки показана на рисунке.
Для проведения эксперимента можно использовать водный раствор сульфата меди (CuSO4), а в качестве электродов - медные пластины. Заряд электрона может быть определен по формуле: 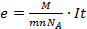 , полученной из закона Фарадея для электролиза. Здесь m - масса выделившегося на электроде вещества, М - молярная масса вещества, n - валентность этого вещества, NA- постоянная Авогадро, I - сила тока, прошедшего через раствор электролита, t -время прохождения тока.
, полученной из закона Фарадея для электролиза. Здесь m - масса выделившегося на электроде вещества, М - молярная масса вещества, n - валентность этого вещества, NA- постоянная Авогадро, I - сила тока, прошедшего через раствор электролита, t -время прохождения тока.
Масса выделившейся на катоде меди определяется путем взвешивания катода до и после проведения опыта. Поэтому m=m2-m1, и формула для определения заряда электрона примет вид:
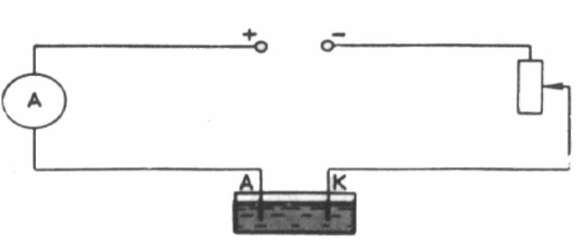
Для измерения силы тока используют школьный амперметр, время измеряется часами. Реостат в цепи необходим для регулирования силы тока.
Пример выполнения
| измерено | вычислено | |||||||||||||||
| m1 | m2 | m | t | I | Δиm | Δ0m | Δm | Δиt | Δ0t | Δt | ΔиI | Δ0I | ΔI | 
| Δe | Ԑe |
| кг | кг | кг | с | А | кг | кг | кг | с | с | с | А | А | А | Кл | Кл | % |
Молярная масса меди М=0,0635 кг/моль (при выполнении работы он-лайн с другим веществом данные можно получить в интерактивной работе)
Используем следующие формулы для заполнения таблицы:
1) Δиm - абсолютная погрешность Δиm = 0,000001 кг
Δ0m - абсолютная погрешность отсчета Δ0m = 0,0000005 кг
Δm - максимальная абсолютная погрешность Δm=Δиm+Δ0m=0,000001+0,0000005=0,0000015 кг
2) Δиt = 1 Δ0t = 0,5 Δt = Δиt + Δ0t = 1 + 0,5 = 1,5
3) ΔиI = 0,05 Δ0I = 0,025 ΔI = ΔиI + Δ0I = 0,05 + 0,025 = 0,075
4) 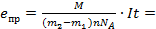
5) 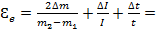
6) Δe= 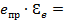
7) Запишите результат с учетом погрешности: 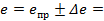
Вывод: ________________________________________________________________________________
_______________________________________________________________________________________
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|