
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практическая работа №1. Приготовление раствора соли с определенной массовой долей растворенного вещества». Правила техники безопасности во время выполнения практической работы. Порядок выполнения работы. m (рас. в-ва)= w
Практическая работа №1
«Приготовление раствора соли с определенной массовой долей растворенного вещества»
Цель: научиться готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовать навыки работы с лабораторным оборудованием.
Реактивы: кристаллические соли, калий хлорид, натрий нитрат, натрий хлорид, дистиллированная вода.
Оборудование: технохимические весы с гирьками, химический стакан, стеклянная палочка, шпатель.
Правила техники безопасности во время выполнения практической работы
Для насыпания твердых веществ следует пользоваться шпателем. Брать реактивы не защищенными руками брать нельзя. Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой. Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
Порядок выполнения работы
1.Вычислить массы соли и воды, которые необходимо взять для приготовления определенного раствора. Массовая доля w – это отношение массы растворенного вещества к массе раствора. Выражается в процентах.
Определяем массу растворенного вещества (соли), которая необходима для приготовления раствора по формуле:
m (рас. в-ва)= w
Находим массу воды. Посколько масса раствора состоит из массы растворенного вещества и массы воды, то масса воды равна разницы между массой растворенного вещества и массой раствора.
Вычисляем объем воды, так как взвешивать воду на весах нельзя. Плотность воды при температуре +25°С равна 1 г/см3.
V=;
После вычисления массы соли и объема воды необходимо взвесить на весах необходимую массу соли. Для этого используют технохимические весы, которые дают результаты с точностью до 0,01 г.
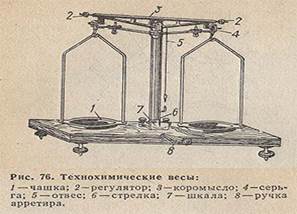
2.Отмеряем с помощью мерного цилиндра необходимый объем дистиллированной воды. Наливаем в мерный цилиндр дистиллированную воду так, чтобы нижний уровень вещества касался выбранной отметки. Во время измерения цилиндр должен находиться в вертикальном положении, а глаза наблюдающего и значение объема на одном расстоянии.
3.Вливаем отмеренный объем воды в химический стакан с солью. Аккуратно перемешиваем содержимое стеклянной палочкой до полного растворения соли.
Составляем отчет в такой форме:
1. Вычисляем массу соли и объем воды, необходимый для приготовления раствора.
2. Взвешиваем на весах соль определенной массы и высыпаем ее в химический стакан.
3. Отмеряем с помощью мерного цилиндра воду необходимого объема и выливаем ее в химический стакан.
4. Перемешиваем содержимое химического стакана стеклянной палочкой для полного растворения.
Задания
А) приготовить 20 г раствора с массовой долей хлорида калия 0,05;
Б) приготовить 25 г раствора с массовой долей нитрата натрия 4%;
В) приготовить 10 г раствора с массовой долей хлорида натрия 10%;
Наблюдения: соль растворилась.
Выводы: взята соль с растворенным веществом. В данном растворе соль является растворенным веществом, вода – растворитель.
Общий вывод работы: во время выполнения практической работы научились готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовали навыки работы с лабораторным оборудованием.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|