
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Диаграмма состояния для сплавов, образующих химические соединения.
1.1. ЦелИ и задчи изучения диаграмм состояния
Диаграмма состояния представляет собой графическое изображение зависимости температур фазовых превращений в сплавах от их состава.
Цель изучения диаграмм состояния сплавов:
· научиться по диаграмме состояния устанавливать, какие процессы происходят в сплавах при их охлаждении, какие при этом образуются фазы и структуры сплавов разного состава;
· научиться анализировать процессы фазовых превращений в зависимости от изменения температуры сплава;
· выявлять взаимосвязь механических и технологических свойств сплавов от соответствующего фазового и структурного состояния.
По диаграммам состояния можно устанавливать не только температуры фазовых превращений в сплавах любого состава, но и качество и количество фаз в разных областях диаграммы состояния. Однако этим не исчерпывается практическая значимость диаграмм состояния сплавов. В частности, разбирая процессы, происходящие при охлаждении сплава, по диаграмме состояния можно выявить, в какой форме проявляются образующиеся фазы при охлаждении сплава.
Фазой называется однородная часть системы, образованная компонентами сплава, которая во всех своих точках имеет одинаковые составы, строение и свойства. Жидкая фаза представляет собой раствор расплавленных компонентов. Твердые фазы являются зернами, имеющими определенную форму, размер, состав, структуру и свойства. Это могут быть твердые растворы, химические соединения, зерна чистых компонентов, не образующих с другими компонентами ни твёрдых растворов, ни химических соединений.
Форма проявления фаз называется структурой сплава. Возможность по диаграмме состояния прогнозировать структуру, образующуюся из сплавов разного состава, имеет очень большое практическое значение, так как в двухфазных сплавах не фазы, а именно структуры сплавов определяют их механические свойства. Так, например, стали и белые чугуны состоят из одних и тех же фаз, но свойства этих сплавов сильно различаются именно потому, что структуры этих сплавов разные.
Имеются тысячи разработанных диаграмм состояния сплавов. Все их выучить механически невозможно. Поэтому специалист должен уметь мысленно представить те процессы, которые происходят в сплавах и образуют их структуру и свойства, чтобы оптимально воздействовать на технологический процесс.
Для этого необходимо: 1) ясное понимание особенностей строения основных фаз в сплавах, которыми являются твердые растворы, химические соединения, чистые компоненты; 2) знание, как эти фазы обозначаются; 3) знание признаков этих фаз; 4) умение по диаграмме состояния определить состав и количество фаз; 5) умение логически мыслить.
Для выработки навыка разбора процессов, происходящих при охлаждении конкретного сплава, необходимо обязательно выполнение следующих действий: строить кривую охлаждения разбираемого сплава; против участков кривой охлаждения схематично изображать состояние фаз (структуру) сплава; письменно объяснять процесс, происходящий в сплаве при рассматриваемых температурных условиях.
1.2. ПРАВИЛО ФАЗ
При рассмотрении процессов превращения в диаграммах равновесного состояния сплавов широко применяется так называемое «правило фаз», дающее возможность проверить правильность построения диаграмм и теоретически обосновать направление протекания процессов превращения для установления равновесного состояния системы, которое определяется следующими переменными факторами: температурой, давлением и составом фаз системы (концентрацией).
Число переменных величин (концентрация фаз, температура, давление), которые могут изменяться независимо друг от друга, называется числом степеней свободы или вариантностью системы.
Число степеней свободы зависит от количества компонентов, числа фаз в системе и переменных внешних условий – температуры и давления. Так как давление в практических условиях изменяется в небольших пределах, не оказывая существенного влияния на процессы превращения, то основным переменным фактором является только температура и тогда уравнение «правила фаз» имеет вид
 (1.1)
(1.1)
 где С ≥ 0 – число степеней свободы (вариантность системы), К – число компонентов в системе, Ф – количество фаз, находящихся в равновесии при рассматриваемых условиях.
где С ≥ 0 – число степеней свободы (вариантность системы), К – число компонентов в системе, Ф – количество фаз, находящихся в равновесии при рассматриваемых условиях.
Если число степеней свободы системы равно нулю (С = 0), то такое равновесие называют нонвариантным (безвариантным). Это означает, что сплав с данным числом фаз может существовать только при определенных условиях: при постоянной температуре и определенной концентрации всех находящихся в равновесии фаз. Если С = 1, то такая система называется моновариантной (одновариантной), т. е. чтобы не нарушилось равновесное состояние фаз, можно изменить либо концентрацию фаз, либо температуру. Когда С = 2, система бивариантна (двухвариантна). Наличие одной или двух степеней свободы позволяет изменять одну или две переменных без изменения числа фаз.
1.3. Правило отрезков
При анализе строения и свойств сплавов рассматривается состав фаз и их количественное соотношение. Для определения количества фаз и их концентрации в любой точке двухфазной области диаграммы состояния сплавов служит «правило отрезков (рычага)».
На рис. 1.1 приведена диаграмма состояния сплавов с неограниченной растворимостью в твердом состоянии. При температуре t1 сплав состоит из α-твёрдого раствора и жидкой фазы. Для определения массового или объемного соотношения фаз и их состава для сплава I при температуре t1 проводим через данный температурный уровень горизонтальную линию (коноду) до пересечения с ближайшими линиями диаграммы АВС и АDС, ограничивающими двухфазную область. Проекции точек пересечения В, D, спроектированные на ось концентрации В’, D’ показывают состав (концентрацию) фаз: жидкая содержит 20 % В, твердая – 72 % В.
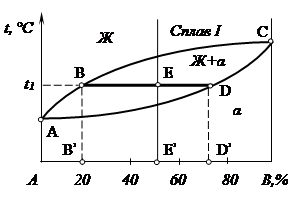
Рис. 1.1. Применение «правила отрезков» для определения концентрации фаз
в двухфазной области диаграммы
Отрезки, лежащие на температурной горизонтали (коноде) между точками концентрации фаз (В, D) и средней точкой, соответствующей концентрации исходного сплава (Е), обратно пропорциональны количеству этих фаз:
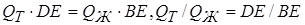 . (2.2)
. (2.2)
Иными словами, количество фазы, например жидкости, характеризуется величиной противолежащего отрезка ЕD, а количество кристаллов
α-твёрдого раствора – величиной противолежащего отрезка ВЕ.
С помощью правила отрезков можно определить не только фазовый состав сплава, но и количественное соотношение структурных составляющих, например избыточных кристаллов и эвтектики.
Для определения количественного соотношения фаз:
 (2.3)
(2.3)
Для определения веса фаз на 1 килограмм сплава:
 (2.4)
(2.4)
1.4. Общий Обзор диаграмм состояния
Как известно, вид диаграммы состояния зависит от характера взаимодействия компонентов в жидком и твердом состояниях, возможности образования устойчивых и неустойчивых химических соединений, протекания тех или иных нонвариантных превращений. Различные варианты простейших (или типовых) диаграмм состояний как диаграмм равновесия систем безымянных компонентов А и В приведены ниже.
1. Диаграмма состояния для сплавов, образующих смеси из чистых компонентов.
Общий вид диаграммы для случая, когда оба компонента сплава в жидком состоянии неограниченно растворимы, а в твердом – не растворяются, не образуют химических соединений и не имеют полиморфных превращений, представлен на рис. 1.2а. Фазы: жидкость – Ж, кристаллы – А и В. Линия АСВ– линия ликвидус; линия ДСЕ – линия солидус. На линии АС начинают выделяться кристаллы А; на линии СВ – кристаллы В; на линии ДСЕ из жидкости концентрации С одновременно выделяются кристаллы А и В. Эвтектическая смесь двух видов кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой.
2. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии.
На рис. 1.2б приведена диаграмма состояния для сплавов с неограниченной растворимостью компонентов друг в друге в жидком и твердом состоянии, имеющих одинаковые типы решеток, небольшую разницу атомных радиусов (до 10–12 %) и сходное строение наружных электронных оболочек, т. е. близость химической природы металлов.
Линия АМВ– линия ликвидус; линия АNВ – линия солидус; фаза α представляет собой неограниченный твёрдый раствор замещения компонентов А и В, зерна этой фазы имеют единую кристаллическую решетку, но у сплавов разного состава число атомов компонентов А и В в элементарных ячейках решетки различно.
3. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии, с эвтектикой.
На рис. 1.2в приведена диаграмма состояния для сплавов с ограниченной растворимостью компонентов друг в друге в твердом состоянии, с эвтектическим превращением. Ограниченные твердые растворы на основе компонентов А и В образуются, когда последние заметно отличаются строением и размером атомов, кристаллической структурой и физико-механическими свойствами. Ограниченные твердые растворы могут образовываться по типу замещения и внедрения.
Линия АСВ – линия ликвидус; линия АDCEВ – линия солидус; фаза α является твердым раствором компонента В в А; фаза β представляет собой твёрдый раствор компонента А в В. Кривые DM и EN – линии ограниченной растворимости в твердом состоянии (сольвус), отражающие характер изменения растворимости компонентов друг в друге в зависимости от температуры. Растворимость компонента В в компоненте А уменьшается с понижением температуры (линия DM). Растворимость компонента А в компоненте В не зависит от температуры (линия EN).
DCE – линия эвтектического превращения ЖВ → (αD+βE). Смесь получившихся в результате данной реакции ограниченных твёрдых растворов αD и βE называется эвтектической (эвтектикой). Сплавы, располо- женные между точкой максимальной растворимости М и эвтектической точкой В, называют доэвтектическими, а сплавы, расположенные между B и N, – заэвтектическими.
4. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии, с перитектикой.
На рис. 1.2г показана диаграмма состояния для сплавов с ограниченной растворимостью в твердом состояния с перитектическим превращением. Диаграммы такого типа образуют металлы с небольшой разницей в строении атомов и их размеров, но заметно отличающиеся друг от друга температурами плавления.
Линия АСВ – линия ликвидус; линия АDEВ – линия солидус; линия
ВDE – линия перитектического превращения, которое заключается в том, что жидкость реагирует с ранее выпавшими кристаллами (ЖВ+βЕ) и образует новый вид кристаллов (ЖВ+αD). Структура двухфазного сплава представляет собой смесь, в которой фаза, выделившаяся ранее (β-фаза), окружена фазой, выделившейся позднее (α-фаза).
5. Диаграмма состояния для сплавов, образующих химические соединения.
Такая диаграмма получается (рис. 1.2д), когда сплавляемые компоненты образуют устойчивое химическое соединение АnВm, не диссоциирующее при нагреве вплоть до температуры плавления и образующее промежуточную фазу постоянного состава. Химическое соединение считается устойчивым, если оно плавится без разложения.
При концентрации, соответствующей химическому соединению АnВm, отмечается характерный перелом на кривой свойств. Это объясняется тем, что некоторые свойства химических соединений обычно резко отличаются от свойств образующих их компонентов. Обычно такие диаграммы состояния характерны для систем, образованных металлами и элементами, которые обладают и металлическими, и неметаллическими свойствами.
В ряде диаграмм состояния сплавов, образующих химические соединения (рис. 1.2е), могут возникать промежуточные фазы переменного состава (δ-фаза), имеющие сравнительно широкие области существования. Эти фазы представляют собой твердые растворы замещения или внедрения в кристаллической решетке химического соединения. Для этих фаз обычно характерны свои кристаллические решетки, отличные от кристаллических решеток компонентов.
Помимо устойчивых химических соединений, которые плавятся (кристаллизуются) при постоянной температуре, в диаграммах могут образовываться и неустойчивые химические соединения, распад которых происходит, не доходя до температуры плавления.
6. Диаграмма состояния для сплавов с полиморфным превращением одного из компонентов.
Полиморфизм (греч.) – многоформие, способность веществ иметь различную кристаллическую структуру в зависимости от внешних условий – температуры и давления.
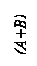  а)
а)
|  б)
б)
|
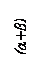  в)
в)
|  г)
г)
|
  д)
д)
|    е) е)
|
 ж)
ж)
|   з)
з)
|
Рис. 1.2. Простейшие (типовые) диаграммы состояния сплавов
Таблица 1.1
Типы элементарной кристаллической решетки некоторых элементов
| Металл (элемент) | Поли- морфная модифи- кация | Интервал теператур устойчивого состояния, °С | Тип кристаллической решетки |
| Fe | α γ α(δ) | <911 911–1392 1392–1539 | Кубическая объемно центрированная Кубическая гранецентрированная Кубическая объемно центрированная |
| Co | α β | <450 450–1480 | Гексагональная плотноупакованная Кубическая гранецентрированная |
| Sn | α β | <18 18–232 | Алмазная Тетрагональная объемноцентрированная |
| Mn | α β γ δ | <700 700–1079 1079–1243 1143–1244 | Кубическая сложная многоатомная Кубическая сложная многоатомная Тетрагональная гранецентрированная Кубическая объемно центрированная |
| Ti | α β | <882 882–1660 | Гексагональная плотноупакованная Кубическая объемно центрированная |
| Zr | α β | <867 867–1860 | Гексагональная плотноупакованная Кубическая объемно центрированная |
| U | α β γ | <668 668–720 720–1132 | Орторомбическая Тетрагональная Кубическая объемно центрированная |
| Ca | α β | <450 450–816 | Гексагональная плотноупакованная Кубическая гранецентрированная |
| Si |
| <1414 | Алмазная |
| P | <44 | Кубическая | |
| W | <3380 | Кубическая объемно центрированная | |
| Cu | <1083 | Кубическая гранецентрированная | |
| La | α β γ | <310 310–844 844–920 | Кубическая обьемноцентрированнная Кубическая гранецентрированная Гексагональная плотноупакованная |
| Mg |
| <650 | Гексагональная плотноупакованная |
| Pb | <327 | Кубическая гранецентрированная | |
| Al | <657 | Кубическая гранецентрированная |
При полиморфическом превращении изменяется не только форма элементарной ячейки, но и характер и свойства кристаллов.
Полиморфизмом обладают многие металлы (Fe, Ti, Mn и др.), неметаллы (С, S и др.) и промежуточные фазы (TiCr2, BaPb и др.). Разные полиморфные модификации обозначаются буквами греческого алфавита – α, β, γ и т. д. На диаграмме состояния каждая полиморфная модификация имеет свою область существования и образующиеся твердые растворы на их основе отделены друг от друга двухфазными областями.
В табл. 1.1 приведены типы элементарной кристаллической решетки и температурные инервалы их существования для некоторых металлов и неметаллов.
Простейшая диаграмма состояния системы с рядом γ-твёрдых растворов между высокотемпературной модификацией компонента А и компонентом В показана на рис. 1.2ж. Линии CD и CE – линии начала и конца полиморфного превращения γ → α. В сплавах участка Е – D подобное превращение до конца не доходит и при комнатной температуре они сохраняют двухфазную структуру (γ+α). Сплавы, лежащие правее точки D, полиморфного превращения не испытывают и при всех температурах ниже солидуса имеют структуру γ-раствора.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|