
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ГСО и Стандарт-титры
Химические реактивы. Понятия и классификация
Химические реактивы – это вещества, которые используются в химических и медицинских лабораториях для анализа веществ, приготовления растворов, проведения реакции, изготовлении красителей, моющих средств, ароматизаторов и т.п. Реактивы делятся на несколько основных видов: 
- Органические вещества;
- Неорганические вещества;
- Реактивы, в состав которых входят радиоактивные элементы;
- Аналитические реактивы;
- Растворители;
- Индикаторы.
Органические реагенты бывают трех видов: растворители; кислоты; соли и соединения. Чаще всего они используются для титриметрии, люминесцентного анализа, фотометрии и др. Преимуществом данных реактивов, пожалуй, является их высокая чувствительность и избирательность, благодаря которым можно использовать определенный реагент для определения какого-то одного иона даже в присутствии мешающих ионов.
Неорганические реагенты – это соли, кислоты, оксиды, гидроксиды, металлы и неметаллы. Реактив Несслера также является неорганическим веществом.
Радиоактивные реактивы содержат изотопы: Н2, С14, N15, О17, О18 и т.д.
Аналитические реактивы используют для приготовления некоторых растворов и проведения аналитических опытов в учебных и научно-исследовательских заведениях.
Растворителив свою очередь тоже делятся на органические и неорганические. Они могут быть как одним веществом, так и смесью из двух, трех и т.д.
Индикаторы подразделяются на 4 группы: металлоиндикаторы; редокс-индикаторы; кислотно-основные и адсорбционные индикаторы. Меняя цвет раствора, в который их добавляют, они показывают, какая реакция произошла в растворе и какие ионы там присутствуют. Индикаторы по-разному проявляют себя в разных pH и при образовании комплексов, осадков и других соединений.
Практически все вещества в природе имеют в себе примеси. На заводе по производству реактивов, прежде чем получить нужное вещество, оно проходит множество этапов обработки. В связи с этим полученный реактив не всегда получается чистым и имеет до 5% примесей. По степени чистоты все химические реактивы классифицируются на 5 групп:

- Технический (тех.);
- Чистый (ч.);
- Чистый для анализа (ч.д.а.);
- Химически чистый (х.ч.);
- Особо чистый (ос.ч.).
Помимо общепринятых сокращений, на банках с веществами ставятся метки – цветные полосы, которые помогают быстро сориентироваться, какой чистоты это вещество. Техническиереактивы – это реактивы, содержащие в себе около 5% примесей и только 95% основного вещества. Эта квалификация считается самой низшей. На упаковке метка обозначается коричневым цветом.
Чистыереактивы содержат в себе от 98% основного вещества. Полоса на упаковке обозначается зеленым цветом.
Чистый для анализареактив должен содержать в себе много больше 98% основного компонента и минимальное количество примесей. Цвет для такого реактива – синий.
Химически чистые реактивы являются высшей степенью чистоты реактива с содержанием в себе 99 и более процентов. Цвет – красный.
Примеси в растворах мешают проведению анализа, приготовлению растворов и т.д. Чем их больше, тем менее точным получится результат проделанного опыта.Особо чистые реактивы содержат настолько малую долю примеси, что ошибки такого рода практически сводятся к нулю.
ГСО и Стандарт-титры
ГСО – это некий образец вещества, либо материала, по химическому составу и физическим свойствам который схож с какой-то группой веществ или материалов и прошедший метрологическую аттестацию. Государственный стандартный образец нужен для метрологического анализа объектов окружающей среды, химической и нефтяной продукции.
 Стандарт-титры представляют собой запаянные ампулы или пластиковые флаконы с определенным количеством какого-либо вещества и служат для приготовления раствора с определенной концентрацией или с определенным значением pH, в случае со стандарт-титрами для приготовления буферных растворов. Приготовление растворов с помощью стандарт-титра происходит следующим образом: в мерную колбу, объемом 1000 мл (или другого объема, указанного в паспорте), помещают лабораторную воронку, в которую вставляется стеклянный бойок, с помощью которого пробивается запаянная часть ампулы с одного конца, затем с другого. Все содержимое ампулы переносится в колбу через воронку, путем промывания ампулы дистиллированной водой. Важно, чтобы все содержимое ампулы перешло в колбу. Далее объем доводят до метки на мерной колбе. Готовые растворы хранят в плотно закрытой лабораторной посуде в темном месте.
Стандарт-титры представляют собой запаянные ампулы или пластиковые флаконы с определенным количеством какого-либо вещества и служат для приготовления раствора с определенной концентрацией или с определенным значением pH, в случае со стандарт-титрами для приготовления буферных растворов. Приготовление растворов с помощью стандарт-титра происходит следующим образом: в мерную колбу, объемом 1000 мл (или другого объема, указанного в паспорте), помещают лабораторную воронку, в которую вставляется стеклянный бойок, с помощью которого пробивается запаянная часть ампулы с одного конца, затем с другого. Все содержимое ампулы переносится в колбу через воронку, путем промывания ампулы дистиллированной водой. Важно, чтобы все содержимое ампулы перешло в колбу. Далее объем доводят до метки на мерной колбе. Готовые растворы хранят в плотно закрытой лабораторной посуде в темном месте.
Все химические реактивы по степени опасности согласно СанПиН и ГОСТу делятся на классы: 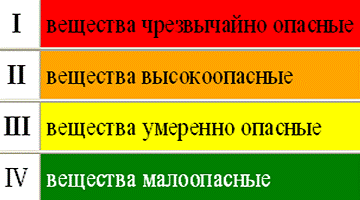
- 1-й класс опасности. Сюда входят чрезвычайно опасные вещества. Их ПДК (предельно допустимая концентрация) чуть меньше 0,1 мг. Концентрация, превышающая этот показатель, приводит к летальному исходу. К таким веществам относятся ртуть, цианид калия, никотин и т.д.
- 2-й класс опасности. Высокоопасные вещества. Их ПДК = до 1мг. К таким веществам относятся литий, свинец, мышьяк, кадмий, хлороформ и т.д.
- 3-й класс опасности. Умеренно опасные вещества. ПДК = до 10 мг/м³. К таким веществам относятся соединения марганца, алюминия, бензин и т.д.
- 4-й класс опасности. Малоопасные вещества. ПДК = более 10мг. Самые популярные и известные всем вещества: керосин, аммиак, алюминий, этанол, соединения железа и т.д.
Приготовление растворов 
Все вещества обладают таким свойством, как растворимость. Растворимость вещества выражается в граммах вещества на 100 граммов раствора (растворителя) – сколько граммов растворенного вещества содержится в 100 граммах раствора (растворителя).
Для приготовления раствора заданной концентрации необходимо пипеткой перенести нужный объем вещества в мерную колбу заданного объема и довести до метки дистиллированной водой. Для расчёта можно воспользоваться формулой C1V1=C2V2, где C1 – концентрация исходного раствора, а V1 – его объем; C2 – необходимая концентрация, а V2 – неизвестное, т.е. тот объем, который нужно найти для конечного раствора: V2= C1V1/ C2. Самое важное правильно при разбавлении концентрированных кислот – нужно добавлять кислоту в воду, а не наоборот: это чревато такими последствиями, как разбрызгивание кислоты и попадание ее на кожу и одежду. Это правило необходимо знать не только химикам, но и домашним хозяйкам, которые в быту пользуются разбавлением кислот, например, уксусной.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|