
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дата: 23.04.2020 электив по химии 11
Дата: 23.04.2020 электив по химии 11
Тема: Химическое равновесие
Химическое равновесие и условия его смещения
1. Среди всех известных реакций различают реакции обратимые и необратимые. При изучении реакций ионного обмена были перечислены условия, при которых они протекают до конца
Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми.
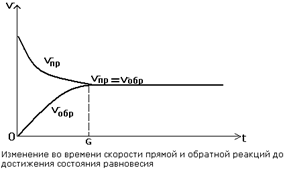 2. В определенный момент времени скорости прямой и обратной реакций становятся равными.
υпр = υобр
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Зависимость химического равновесия
Принцип Ле-Шателье (1885 год) определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
N2 (г) + 3H2 (г) ↔ 2NH3 (г)
При ↑ концентрации азота (N2) равновесие будет смещаться →
При ↑ концентрации аммиака (NH3) равновесие будет смещаться ←
Изменение массы твердого вещества не изменяет положение равновесия!!!
Константа равновесия – Кр
Кр = [продуктов реакции]n/ [исходные вещества]m
Где n и m – коэффициенты перед веществами
Так для реакции: N2 (г) + 3H2 (г) ↔ 2NH3 (г) + 92,4 кДж константа равновесия выражается:
Kp = [NH3]2/ [N2][H2]3 – константа равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N2 (г) + 3H2 (г) ↔ 2NH3 (г) + 92,4 кДж
При ↑ температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N2 (г) + O2 (г) ↔ 2NO (г) – 180,8 кДж
При ↑ температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных веществ) – при увеличении давления, равновесие смещается в сторону образования меньшего количества газообразных веществ (т.е. смотрим на коэффициенты).
N2 (г) + 3H2 (г) ↔ 2NH3 (г)
1V - N2
3V - H2
2V – NH3
При повышении давления (P): до реакции 4V газообразных веществ → после реакции 2V газообразных веществ, следовательно, равновесие смещается вправо (→).
Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
4) Влияние катализаторов (ингибиторов)
На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора изменяется скорость как прямой, так и обратной реакций, поэтому равновесие не смещается.
2. В определенный момент времени скорости прямой и обратной реакций становятся равными.
υпр = υобр
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Зависимость химического равновесия
Принцип Ле-Шателье (1885 год) определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
N2 (г) + 3H2 (г) ↔ 2NH3 (г)
При ↑ концентрации азота (N2) равновесие будет смещаться →
При ↑ концентрации аммиака (NH3) равновесие будет смещаться ←
Изменение массы твердого вещества не изменяет положение равновесия!!!
Константа равновесия – Кр
Кр = [продуктов реакции]n/ [исходные вещества]m
Где n и m – коэффициенты перед веществами
Так для реакции: N2 (г) + 3H2 (г) ↔ 2NH3 (г) + 92,4 кДж константа равновесия выражается:
Kp = [NH3]2/ [N2][H2]3 – константа равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N2 (г) + 3H2 (г) ↔ 2NH3 (г) + 92,4 кДж
При ↑ температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N2 (г) + O2 (г) ↔ 2NO (г) – 180,8 кДж
При ↑ температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных веществ) – при увеличении давления, равновесие смещается в сторону образования меньшего количества газообразных веществ (т.е. смотрим на коэффициенты).
N2 (г) + 3H2 (г) ↔ 2NH3 (г)
1V - N2
3V - H2
2V – NH3
При повышении давления (P): до реакции 4V газообразных веществ → после реакции 2V газообразных веществ, следовательно, равновесие смещается вправо (→).
Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
4) Влияние катализаторов (ингибиторов)
На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора изменяется скорость как прямой, так и обратной реакций, поэтому равновесие не смещается.
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|