
- Р Р‡.МессенРТвЂВВВВжер
- ВКонтакте
- РћРТвЂВВВВнокласснРСвЂВВВВРєРСвЂВВВВ
- Telegram
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВРЎР‚
- LiveJournal
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ХИМИЯ НЕМЕТАЛЛОВ
ХИМИЯ НЕМЕТАЛЛОВ
ПОНЯТИЯ:
1. Неметаллический элемент– это химический элемент, который образует простое вещество – неметалл. Из известных 118 химических элементов к неметаллическим относятся 22.
2. Неметаллическая активность химического элемента– это способность атома данного химического элемента принимать электроны. Электроны легче принимать, чем меньше атомный радиус и больше число электронов на последнем (внешнем) энергетическом уровне.
В периодической системе химических элементов Д.И. Менделеева неметаллическая активность в периодах увеличивается слева направо, а в группах – снизу вверх, вследствие уменьшения атомного радиуса. Наиболее активными неметаллическими элементами являются: I место – F; II место – O; III место – N и Cl.
3. Неметалл (как простое вещество)– это простое вещество, обладающее неметаллическими свойствами, т.е. отсутствием металлического блеска, пластичности и ковкости, высокой тепло- и электропроводности.
4. Инертные (благородные) газы – это химические элементы VIII-А группы (VIII группы, главной подгруппы) периодической системы химических элементов Д.И. Менделеева: He (гелий), Ne (неон), Ar (аргон), Кr (криптон), Xe (ксенон), Rn (радон). Своё название они получили, вследствие того, что эти химические элементы образуют одноатомные простые вещества, которые являются неактивными (инертными).
5. Галогены(от греч. hals – соль, genes – рождающий) – это химические элементы VII-А группы (VII группы, главной подгруппы) периодической системы химических элементов Д.И. Менделеева: F, Cl, Br, I, At (астат). Своё название они получили, вследствие того, что их простые вещества легко взаимодействуют с металлами, образуя соли.
6. Халькогены(от греч. halс – медь, genes – рождающий) – это химические элементы VI-А группы (VI группы, главной подгруппы) периодической системы химических элементов Д.И. Менделеева: O, S, Se (селен), Te (теллур). *Своё название они получили, вследствие того, что эти химические элементы образуют большое число минералов (руд) меди в земной коре.
7. Аллотропия(от греч. allos – другой и tropos – поворот, образ, свойство) – это явление образования одним и тем же химическим элементом нескольких простых веществ. Каждое простое вещество обладает своей совокупностью физических и химических свойств и называется аллотропным видоизменениемилимодификацией. Термин ввёл Й. Я. Берцелиус (Швеция) в 1841 году.
*Известно два основных вида аллотропии:
а) по числу атомов (например: О2 – кислород; О3 – озон);
б) по строению кристаллической решетки кристалла (например: С∞ – алмаз, С∞ – графит, С∞ – карбин).
8. **Горная порода – это плотное или рыхлое геологическое тело (природный агрегат), состоящее из одного или нескольких минералов, которое образуется на поверхности или в глубинах Земли. Горная порода бывает магматической, осадочной или метаморфической.
9. **Минерал (от лат. minerale – руда) – это геологическое тело, приблизительно однородное по химическому составу и физическим свойствам. В настоящее время известно более 3000 минералов.
10. Плавиковая (фтороводородная) кислота – это раствор фтороводорода (HF) в воде. Своё название она получила из-за плавикового шпата (СаF2), из которого получают фтороводород. Особенностью этой кислоты является то, что её хранят в пластмассовой (тефлон, полиэтилен и др.) таре, т.к. она разъедаетстекло.
11. Фторид – это средняя соль фтороводородной (плавиковой) кислоты. Например: KF – фторид калия.
12. Хлорид – это средняя соль хлороводородной (соляной) кислоты. Например: KCl – хлорид калия.
13. Бромид – это средняя соль бромоводородной кислоты. Например: KBr – бромид калия.
14. Йодид – это средняя соль йодоводородной кислоты. Например: KI – йодид калия.
15. *Возгонка (сублимация)– это явление перехода из твёрдого состояния в газообразное, минуя жидкое состояние. Данное явление характерно для йода, бензойной кислоты, нафталина и некоторых других веществ.
16. Горение – это химическая реакция с участием кислорода, в результате которой происходит окисление веществ и выделение тепла и света.
17. Воздух – это природная однородная смесь газов, главными компонентами которой являются азот, кислород и аргон.
Состав воздуха:
а) по объёму: φ(N2) = 78 %, φ(О2) = 21 %, φ(Ar) = 0,95 %;
б) по массе: ω(N2) = 75,6 %; ω(О2) = 23 %, ω(Ar) = 1,3 %.
Относительная молекулярная масса воздуха: Мr = 29.
18. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых всегда кислород, а вторым элементом может быть как металл, так и неметалл. Общая формула ЭхОуII(-2)
19. Круговорот кислорода в природе– это естественный процесс поглощения и выделения кислорода на Земном шаре.
Практический весь свободный кислород нашей планеты возник и сохраняется благодаря природному процессу – фотосинтезу. **Ежегодно растительный мир Земли возвращает в атмосферу приблизительно около 400 млрд. тонн кислорода. Причем, большую долю этого кислорода дают морские водоросли. В результате дыхания животных и растений, а также постоянного гниения, горения и других окислительных процессов – кислород расходуется. Общее количество кислорода, которое выделяется растениями Земного шара намного больше того, что потребляется при дыхании.
20. Фотосинтез – это природный биохимических процесс, протекающий в зелёных листьях растений, с участием хлорофилла, на свету, в результате которого образуются углеводы, и выделяется кислород: 6СО2 + 6Н2О 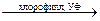 С6Н12О6 + 6О2↑.
С6Н12О6 + 6О2↑.
21. *Озонатор – это прибор для получения озона (от греч. ozo – пахнущий) из кислорода, в результате пропускания через него электрического разряда: 3О2 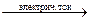 2О3↑.
2О3↑.
22. Гидросульфид – это кислая соль сероводородной кислоты. Например: KHS – гидросульфид калия.
23. Сульфид – это средняя соль сероводородной кислоты. Например: K2S – сульфид калия.
24. Гидросульфит – это кислая соль сернистой кислоты. Например: KНSO3 – гидросульфит калия.
25. Сульфит – это средняя соль сернистой кислоты. Например: K2SO3 – сульфит калия.
26. *Ангидрид – это кислотный оксид, который при взаимодействии с водой образует соответствующую кислоту, причём степень окисления (валентность) в ангидриде и соответствующей кислоте одинакова. Например: сернистый ангидрид S+4O2 при взаимодействии с водой образует сернистую кислоту Н2S+4O3.
27. Гидросульфат – это кислая соль серной кислоты. Например: KНSO4 – гидросульфат калия.
28. Сульфат – это средняя соль серной кислоты. Например: K2SO4 – сульфат калия.
29. **Олеум (от лат. oleum – масло) – это раствор серного ангидрида (SO3 – от 1 до 30 %) в безводной (абсолютной) серной кислоте. Условная формула: Н2S2O7.
30. **Купорос– это техническое название средних солей серной кислоты, в которых металлы двухвалентны. Наиболее известными являются медный (CuSO4•5H2O), железный (FeSO4•7H2O) и цинковый (ZnSO4•7H2O) купоросы.
31. **Абсорбция (от лат. absorption – поглощение) – это явление поглощения (растворения) газа или растворённого вещества другой жидкостью во всём предоставляемом объёме. Например: при получении H2SO4 контактным способом серный ангидрид (SO3) поглощают концентрированной серной кислотой (H2SO4).
32. **Абсорбер (от лат. absorbeo – поглощаю) – это аппарат для проведения абсорбции или для разделения смеси газов с помощью абсорбции. Представляет собой колонну с насадками или тарелками, в которой снизу подаётся газ или раствор, а сверху жидкость – поглотитель (абсорбент).
33. Соль аммония– это сложное вещество, состоящее из катионов аммония (NH4+) и анионов кислотного остатка. Например: (NH4)2SO4 – сульфат аммония.
34. Нашатырный спирт (аммиачная вода)– это техническое название раствора аммиака в воде.
35. Нашатырь– это техническое название хлорида аммония (NH4Cl).
36. Нитрит – это средняя соль азотистой кислоты. Например: KNO2 – нитрит калия.
37. Нитрат – это средняя соль азотной кислоты. Например: KNO3 – нитрат калия.
38. **Селитра– это техническое название средних солей азотной кислоты, в которых металлы одно- или двухвалентны. Наиболее известными являются чилийская или натриевая (NaNO3), индийская или калийная (KNO3), норвежская или кальциевая (Ca(NO3)2), аммонийная или аммиачная (NH4NO3) селитры.
39. **Орто-, метакислоты(от греч. orthos – прямой, meta – после, через, между)– это приставки, употребляемые в названиях кислот, различающиеся содержанием гидроксогрупп (групп –ОН): метакислота – наименьшее, а ортокислота – наибольшее. Например: НPO3 – метафосфорная кислота, Н3PO4 – ортофосфорная кислота.
40. Дигидрофосфат и гидрофосфат – это кислые соли фосфорной кислоты. Например: КH2PO4 – дигидрофосфат калия, К2HPO4 – гидрофосфат калия.
41. Фосфат (ортофосфат) – это средняя соль фосфорной (ортофосфорной) кислоты. Например: K3PO4 – фосфат (ортофосфат) калия.Минеральное удобрение – это сложное вещество, имеющее в своём составе один или несколько питательных элементов для растений (азот, фосфор, калий), которое диссоциирует в почвенном растворе на ионы. Бывает: простым, сложным (комбинированным), комплексным.
42. **Простое минеральное удобрение – это сложное вещество, имеющее в своём составе только один питательный элемент (или азот, или фосфор, или калий), которое диссоциирует в почвенном растворе на ионы. Бывает: азотным, фосфорным или калийным.
43. **Азотное минеральное удобрение– это простое минеральное удобрение, имеющее в своём составе только один питательный элемент – азот, которое диссоциирует в почвенном растворе на ионы. Например: NH4NO3 – аммонийная селитра (нитрат аммония).
44. **Фосфорное минеральное удобрение– это простое минеральное удобрение, имеющее в своём составе только один питательный элемент – фосфор, которое диссоциирует в почвенном растворе на ионы. Например: Са(H2РO4)2×2Н2О – двойной суперфосфат (дигидрат дигидрофосфата кальция).
45. **Калийное минеральное удобрение– это простое минеральное удобрение, имеющее в своём составе только один питательный элемент – калий, которое диссоциирует в почвенном растворе на ионы. Например: KCl – сильвин (хлорид калия).
46. **Сложное (комбинированное) минеральное удобрение – это сложное вещество, имеющее в своём составе любые два питательных элемента, которое диссоциирует в почвенном растворе на ионы. Например: КNO3 – индийская (калийная) селитра (нитрат калия).
47. *Аммофос – это сложное минеральное удобрение, являющееся смесью дигидро- и гидрофосфата аммония (NH4H2PO4 и (NH4)2HPO4), широко применяющееся в сельском хозяйстве.
48. **Комплексное минеральное удобрение – это сложное вещество или смесь, имеющая в своём составе все три питательных элемента, которая диссоциирует в почвенном растворе на ионы. Например: смесь нитрофоска.
49. Алмаз (от араб. аl-mas – твердейший илигреч. adamas – несокрушимый, непобедимый) – это аллотропная модификация углерода, имеющая тетраэдрическую атомную кристаллическую решётку, в которой все связи между атомами углерода одинаковые и равноценные. Самое твердое природное вещество, **по шкале Ф. Мооса имеет 10. Крупнейший в мире алмаз был найден в 1905 году в ЮАР и был назван «Куллинан», его масса составила 3106 карат или 621,2 г.
50. Графит (от греч. grafo – пишу) – это аллотропная модификация углерода, имеющая слоистую атомную кристаллическую решётку в виде шестиугольных колец, причем расстояние между атомами в слое меньше, чем между слоями.
51. *Карбин – это аллотропная модификация углерода, имеющая линейное строение в виде чередующих (–С≡С–С≡С–С≡С–) или повторяющихся (=С=С=С=С=С=С=) длинных цепей атомов углерода.
52. **Фуллерен (букибол, футболен) – это аллотропная модификация углерода, представляющая замкнутые молекулы (С60, С70 и другие), по форме напоминающие футбольный мяч. Впервые получен в 1985 году. Название дано в честь американского архитектора и инженера Р.Б. Фуллера, который прославился изобретением очень прочных шарообразных конструкций.
53. Бриллиант (от франц. brilliant – блестящий) – это драгоценный камень, являющийся специально огранённым алмазом. Оценивается по массе (в каратах), форме, прозрачности, цветовой гамме.
54. **Шкала Мооса – это условная минералогическая шкала твердости, представляющая набор десяти эталонных минералов, с помощью которой определяют относительную твёрдость минерала с помощью царапанья. Впервые шкалу предложил Фридрих Мооса в 1811 году. Значения шкалы изменяются от 1 до 10: тальк (3MgO×4SiO2×H2O) – 1; гипс (СаSO4×2Н2О) – 2; кальцит (CaCO3) – 3; флюорит (CaF2) – 4; апатит (Са5(РO4)3F) – 5; полевой шпат (см. стр. 16) – 6; кварц (SiO2) – 7; топаз – 8; корунд (Al2O3) – 9; алмаз (C¥) – 10.
55. Адсорбция (от лат. ad – на и sorbeo – поглощаю) – это явление самопроизвольного поглощения поверхностью твердого тела или жидкости газов или растворённых веществ в воде или другом растворителе.
56. Адсорбент – это твёрдое вещество или жидкость, на поверхности которого происходит явление адсорбции. Например: древесный уголь, активированный уголь, силикагель (частично обезвоженная кремниевая кислота), алюмосиликагель, вата и др.
57. **Адсорбат – это вещество, которое поглощается поверхностью твёрдого вещества или жидкости в результате явления адсорбции.
58. **Абразивный материал или абразив(от франц. abrasif — шлифовальный или лат. abradere – соскабливать) – это естественный или искусственный твёрдый материал, который применяется для шлифования, точения, резания, а также для изготовления огнеупорных материалов и нагревателей. Например: алмаз, корунд, кварц, карборунд (карбид кремния) и др.
59. Гидрокарбонат – это кислая соль угольной кислоты. Например: КHСO3 – гидрокарбонат калия.
60. Карбонат – это средняя соль угольной кислоты. Например: K2CO3 – карбонат калия.
61. Жёсткость воды– это явление, обусловленное присутствием в природной воде растворимых солей кальция и магния. Бывает: временная (гидрокарбонатная) и постоянная, а вместе они образуют общую жёсткость воды.
62. Временная жёсткость воды обусловлена присутствием в природной воде гидрокарбонатов кальция и магния.
63. Постоянная жёсткость водыобусловлена присутствием в природной воде хлоридов и сульфатов кальция и магния.
64. Силикат – это средняя соль кремниевой кислоты. Например: K2SiO3 – силикат калия.
65. **Алюмосиликаты – это природные соединения, составляющие основную массу земной коры. По химическому составу это силикаты, в которых часть атомов кремния замещена атомами алюминия. Продуктами их выветривания являются глина (каолин) и полевые шпаты (альбит, ортоклаз, анортит и др.). Например: Na2О·Al2O3·6SiO2 – альбит; K2О·Al2O3·6SiO2 – ортоклаз; Al2O3·2SiO2·2Н2O – каолин.
66. Коллоидный раствор (золь) – это раствор, состоящий из очень мелких частиц, равномерно размещенных в однородной среде (например, в воде). Коллоидные растворы занимают промежуточное положение между растворами и взвесями (суспензиями и эмульсиями).
67. Стекло – это аморфный, хрупкий, как правило, прозрачный материал, образующийся при застывании вязкого расплава, полученного при сплавлении песка (SiO2), соды (Na2СО3) и известняка (CaСО3) при температуре 1450-1500˚С. **Иногда соду или (и) известняк заменяют другими компонентами, для получения особых или специальных видов стекал (тугоплавкого, хрустального, оптического и т.д.).
68. **Оконное (натриевое) стекло – это стекло получаемое при застывании вязкого расплава, полученного при сплавлении песка, соды и известняка при температуре 1450-1500˚С. Имеет условную формулу Na2О·CaO·6SiO2.
69. **Тугоплавкое (калийное) стекло – это стекло получаемое при застывании вязкого расплава, полученного при сплавлении песка, поташа (К2СО3) и известняка при температуре около 1600˚С. Имеет условную формулу К2О·CaO·6SiO2.
70. **Хрустальное (свинцовое)стекло – это стекло получаемое при застывании вязкого расплава, полученного при сплавлении песка, поташа и оксида свинца (II) при температуре около 1600˚С. Имеет условную формулу К2О·PbO·6SiO2.
71. **Кварцевое стекло – это стекло получаемое при застывании вязкого расплава, полученного при расплавлении чистого кварца. Оно практически не расширяется при сильном нагревании и не сжимается при сильном охлаждении, а также не боится резких перепадов температур. Имеет формулу SiO2.
72. **Цветные стёкла – это стёкла получаемые при застывании вязких расплавов, получаемых при расплавлении песка, соды (или поташа), известняка с добавлением небольших количеств оксидов металлов или других веществ, которые обеспечивают окрашивание стекла. Например: зелёный цвет – FeO; синий – СoO; фиолетовый – MnO2; розовый – SrO; рубиновый – распылённое Au (золото) и др.
73. Цемент – это строительный материал, получаемый при обжиге смеси глины, известняка и песка (иногда других добавок, например шлака) при температуре 1400-1500˚С во вращающихся трубчатых печах. Затвердевает при смешивании с водой в камнеподобную массу. Бывает: обычный и портлендский.
74. Бетон(от лат. bitumen – горная смола) – это строительный материал, получаемый при смешивании цементного раствора с гравием, щебнем или мелким шлаком.
75. Железобетон– это строительный материал, получаемый при заливании железной арматуры (каркаса) цементным раствором с гравием, щебнем или мелким шлаком.
76. *Керамика – это строительный или декоративный материал, получаемый из глины, песка и других добавок (полевого шпата и т.д.) путём формовки, обжига и сушки. Бывает: «грубая» керамика – кирпич, шамот (огнеупорный материал), клинкер (кислотостойкий материал), черепица, а также «тонкая» керамика – фаянс и фарфор.
77. **Фаянс – это декоративный материал, получаемый из глины, кварца и других добавок путём формовки, сушки и обжига. Является более «грубым» материалом, чем фарфор.
78. **Фарфор – это декоративный материал, получаемый из особых сортов глины и других добавок (чистого кварцевого песка) путём формовки, сушки и двойного обжига. Впервые был получен в Китае.
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|