
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Карбоновые кислоты
Карбоновые кислоты
Цель: изучить строение, способы получения, свойства карбоновых кислот и их производных.
План лекции
1. Строение карбоновых кислот
2. Способы получения
3. Химические свойства карбоновых кислот
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН(малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH бутановая);
непредельные (CH2=CH-COOH пропеновая);
ароматические (C6H5COOH бензойная).
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота:
HCOOH - метановая (муравьиная) кислота,
CH3COOH – этановая (уксусная) кислота.
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Электронная плотность p-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создаётся недостаток электронной плотности, и он притягивает к себе неподелённые пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
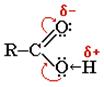
В водном растворе карбоновые кислоты диссоциируют на ионы:
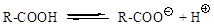
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
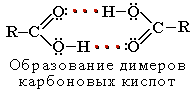
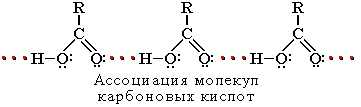
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|