
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов.. Металлотермия
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов.
Он используется для определения принципиальной возможности протекания окислительно-восстановительных реакций металлов (с растворами кислот и солей).
Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Металлы в химических реакциях всегда восстановители. Восстановительную активность металла отображает его положение в электрохимическом ряду напряжений.

Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из солей в растворе те металлы, которые стоят правее 2Fe + 3CuSO4 → 3Cu + Fe2 (SO4)3
3. Металлы, находящиеся в ряду напряжений левее водорода способны вытеснять его из кислот. Zn + 2HCl → ZnCl2 + H2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные) в любых водных растворах прежде сего реагируют с водой.
Восстановительная способность металла, определённая по электрохимическому ряду не всегда соответствует его положению в периодической системе т.к в ряду напряжений учитывается не только радиус атома, но и энергия отрыва электронов.
Металлотермия

Честь открытия в 1856 г. и первого практического применения металлотермии принадлежит Николаю Николаевичу Бекетову - выдающемуся русскому физико-химику и металлургу.
Металлотермия - это металлургический процесс, в основе которого лежит реакция восстановления металла из его кислородного или иного соединения другим более активным металлом.
В методах металлотермии в качестве восстановителей используют Al, Na, Ca, Mg, B, Si и др.
Примеры металлотермических реакций:
Алюмотермия - 2Al + Cr2O3 ® 2Cr + Al2O3
Магнийтермия - Mg + TiCl4 ® Ti + 2MgCl2
Натрийтермия - 2Na + K2BeF4 ® Be + 2NaF + 2KF
Методы металлотермии в настоящее время широко используются в металлургии:
-для получения металлов: Ti, Cr, Mn, V, Zr, Mg, Ba, Ca, Ta, Rb, Cs.
- для получения металлотермических ферросплавов и лигатур, например, феррованадия, феррохрома и др.
- в термической сварке,
- для легирования стали.
Среди металлотермических процессов ведущее место занимает алюмотермия - алюмотермическое восстановление оксидов металлов по реакции:
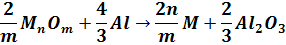
Алюмотермические процессы используются для восстановления оксидов редких тугоплавких металлов (титана, ванадия, ниобия, циркония, вольфрама, молибдена, тантала), а также оксидов хрома, марганца, бария, кальция, железа, никеля.
Широкое применение алюмотермии обусловлено рядом преимуществ:
-высокой восстановительной способностью алюминия;
-возможностью получения более чистых сплавов, чем с кремнием и углеродом;
- простотой производства алюминиевого порошка;
- высокой величиной теплового эффекта реакции;
- высокой температурой кипения, уменьшающей испарение алюминия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|