
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ТЕМА 56 Электрический ток в жидкостях
ФИЗИКА
Урок 56-57 27.04.2020
ТЕМА 56 Электрический ток в жидкостях
Электролиты –жидкие проводники, в которых подвижными носителями зарядов являются ионы. (± ионы)
Электролитическая диссоциация – распад молекул на ионы.
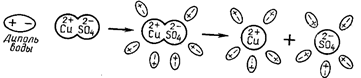
| Интенсивность электролитической диссоциации зависит: 1. От температуры раствора. 2. От концентрации раствора. 3. От рода раствора (его диэлектрической проницае-мости) Ионная проводимость: прохождение тока связано с переносом вещества. | 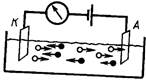
| 
|
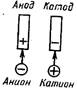
Электрический ток представляет собой сумму токов катионов (в сторону катода) и анионов (в сторону анода).
Электролиз –выделение на электродах вещества, входящего в состав электролита.
Вольт – амперная характеристика для электролитов.
За счет явления поляризации график смещен.
Сопротивление растворов электролитов: I ~ 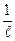 , I ~ S
Уменьшается R с повышением температуры.
Справедлив закон Ома при неизменной концентрации раствора и температуры. , I ~ S
Уменьшается R с повышением температуры.
Справедлив закон Ома при неизменной концентрации раствора и температуры.
|

|
Первый закон Фарадея:масса вещества, выделившегося на катоде, прямо пропорцио-нальна заряду, прошедшему через электролит.
m = kIΔt = kq
где k – электрохимический эквивалент вещества численно равен массе выделившегося вещества, при переносе заряда в 1 Кл. [k] = 1 кг/Кл
Второй закон Фарадея:электрохимические эквиваленты веществ прямо пропорцио-нальны отношениям их масс к валентности.
k = 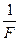 ∙
∙ 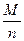
М – молярная масса вещества.
n – валентность иона.
e – модуль заряда электрона.
Объединенный закон Фарадея: m = 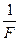
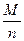 I Δt =
I Δt = 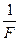
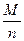 q
q
m = m0N, m0 = 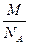 , N =
, N = 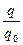 , q = IΔt, q0 = ne, m =
, q = IΔt, q0 = ne, m = 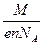 IΔt
IΔt
F = eNA = 96500 Кл/моль – постоянная Фарадея численно равная заряду, который должен пройти через электролит, чтобы на электроде выделился 1 моль одновалентного вещества.
N –число ионов, достигших электрода, q0 – заряд иона
Определение заряда электрона:
m = 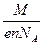 IΔt, e =
IΔt, e = 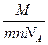 IΔt
IΔt
Применение электролиза:
1. В гальваностегии (никелирование, серебрение).
2. В гальванопластике (изготовление копий); 1838 г., Б.С.Якоби.
3. Электронатирание.
4. Промышленный способ получения кислорода и водорода.
5. Очистка металлов, полученных при выплавке из руды, от посторонних примесей.
6. Электрополировка поверхностей.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|