
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРИМЕР 11.9.. ПРИМЕР 11.10.
ПРИМЕР 11.9.
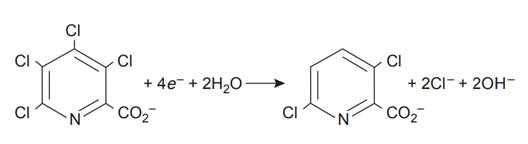
Образец 0,3619 г тетрахлорпиколиновой кислоты, C6HNO2Cl4, растворяют в дистиллированной воде, переносят в мерную колбу объемом 1000 мл и доводят до метки. Для исчерпывающего электролиза с контролируемым потенциалом порции 10,00 мл этого раствора на губчатом серебряном катоде требуется 5,374 Кл заряда. Каково значение число электронов n необходимо для этой реакции восстановления?
Для восстановления молекулы тетрахлорпиколиновой кислоты требуется четыре электрона. Общая реакция, которая приводит к селективному образованию 3,6-дихлорпиколиновой кислоты, составляет
ПРИМЕР 11.10.
Навеску 0,6000 г вольфрамовой присадки перевели в раствор и выделили алюминий в виде оксихинолята. Осадок после очистки растворили и в небольшом количестве концентрированной HCl, раствор внесли в кулонометрическую ячейку и оттитровали выделившийся 8-оксихинолин юромом, генерируемым в электролизе. Конечную точку титрования фиксировали биамперометрически.
Вычислить процентное содержание талюминия в исследуемом образце, если титрование велось при постоянной силе тока 8.0 мА в течение 125 с.
РЕШЕНИЕ
Вычисления проводят на основе закона Фарадея
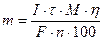 , (1)
, (1)
где m – масса выделившегося металла, г; I – сила тока, А; τ – время электролиза, с; М – молярная масса металла, г/моль; F- постоянная Фарадея, 96500 Кл/моль; n- число электронов, участвующих в электрохимическом процессе; η – выход по току, %.
Отсюда процентное содержание меди в сплаве рассчитывается как
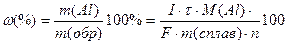
Величину n в данном случае находят на основе следующих соображений. Кулонометрическое титрование провели по методу замещения, так как генерированный бром непосредственно реагировал не с алюминием, а с 8-оксихинолином. Последний был связан с алюминием с стехиометрическом соотношении 3:1.
По уравнению реакции
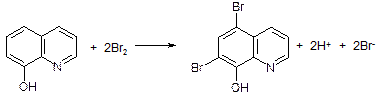
Таким образом, на 1 моль8-оксихинолина приходится 4 моль эквивалентов брома. Следовательно, число электронов, участвующих в расчете на один атом алюминия, составляет n= 3*4=12
Подставляем численные значения в формулу и находим процентное содержание алюминия в образце.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|