
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Электрохимические методы анализа
Электрохимические методы анализа
Хотя возможны многие различные электрохимические методы анализа (рис. 11.1), существует только три основных экспериментальных варианта:
(1) измерение потенциала в статических условиях без протекания тока;
(2) измерение потенциала при управлении током и
(3) измерение тока при управлении потенциалом.
Однако каждая из этих экспериментальных схем основана на законе Ома, согласно которому ток I, проходя через электрическую цепь сопротивления R, генерирует потенциал E;
таким образом
Eг.э. = Ек – Еа – IR
1. Измерение потенциала в статических условиях без протекания тока.
Потенциометрия
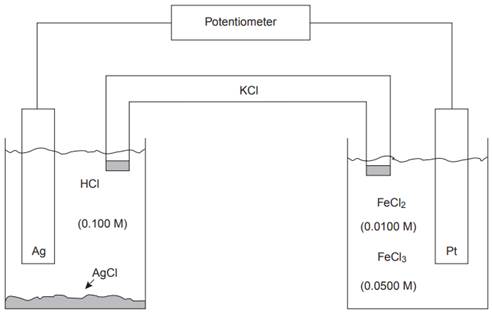
ПРИМЕР 11.1
Какие анодные, катодные и общие реакции протекающие в электрохимической ячейке ответственны за разность потенциалов (смотри рисунок)?
Напишите сокращенную запись для электрохимической ячейки.
РЕШЕНИЕ
На аноде (левая ячейка) происходит окисление Ag до Ag +. Поскольку раствор содержит источник Cl–, протекает анодная реакция
Ag (s) + Cl– (aq) ↔AgCl (s) + e–
Катодная реакция (правая ячейка) - восстановление Fe3 + до Fe2 +.
Таким образом, общая реакция в ячейке представляет собой
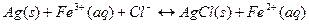
Условное обозначение электрохимической ячейки
Ag (s) | HCl(вод., 0,100 М), AgCl (нас.) || FeCl2(вод 0,0100 М), FeCl3 (водный 0,0500 М) | Pt
Обратите внимание, что катод Pt является инертным электродом, который переносит электроны к полуреакции восстановления. Сам электрод не подвергается окислению или восстановлению.
ПРИМЕР 11.2.
Какова разность потенциалов электрохимической ячейки (элемента)?
С(HCl)=0.100 M
C(FeCl2) = 0.0100 M
C(FeCl3) = 0.0500 M
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|